设NA为阿伏加德罗常数的值,下列说法正确的组合是
a 12 g 金刚石中含有的碳碳键的数目为2NA
b 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 1mol Na2O2与水反应转移的电子数为NA
d 常温下,1 mol·L-1的NH4NO3溶液中含有氮原子的数目为2 NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17gH2O2中含有的电子数为9NA
g 将2molSO2与1molO2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL1mol•L-1AlCl3溶液中阳离子总数大于0.1NA
| A.a c f h | B.a c eg | C.a c e f h | D.b d e h |
将A与B的混合气体1 mol放入容积为2 L的密闭容器内,在一定条件下发生反应:2A(g)+3B(g)  C(g)+ 2D(g) ,经过4min达到平衡,此时容器内的压强是反应前的3/5,以各气体的浓度变化表示的反应速率正确的是()
C(g)+ 2D(g) ,经过4min达到平衡,此时容器内的压强是反应前的3/5,以各气体的浓度变化表示的反应速率正确的是()
| A.vA=0.025 mol·(L·min)-1 | B.vB=0.150mol·(L·min)-1 |
| C.vC=0.0125mol·(L·min)-1 | D.vD=0.050mol·(L·min)-1 |
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是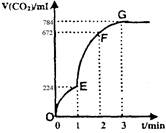
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.04mol/(L·min) |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 |
| D.G点表示收集的CO2的量最多 |
100mL6mol/L硫酸跟过量锌粒反应,在一定温度下,为了减慢反应进行的速率,但又不影响生成氢气的总量。可向反应物中加入适量的
| A.醋酸钠(固体) | B.3mol/L硫酸 | C.碳酸钾溶液 | D.硫酸铵(固体) |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移1 mol电子 |
| C.Na+不断向“水”电池的正极移动 |
| D.AgCl是还原产物 |
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
| A.-1780kJ/mol | B.+1220 kJ/mol | C.-1220 kJ/mol | D.+1780 kJ/mol |