下列实验操作对应的实验现象和解释或结论都正确的是
| 选项 |
实验操作 |
实验现象 |
解释或结论 |
| A |
把S02通人紫色石蕊试液中 |
紫色褪去 |
S02具有漂白性 |
| B |
向NaOH溶液中滴加足量的MgCl2溶液,然后再滴加足量的CuCl2溶液 |
先产生白色沉淀,然后沉淀变蓝色 |
 |
| C |
向某溶液中滴加KSCN溶液 |
溶液变红色 |
溶液中含有Fe2+ |
| D |
将充满N02的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2 |
下列消毒剂,可用于皮肤消毒的是( )
| A.84消毒液 | B.消毒酒精 | C.福尔马林 | D.双氧水 |
ClO2是一种消毒菌杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4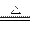 2ClO2↑+K2SO4+2CO2↑+2H2O
2ClO2↑+K2SO4+2CO2↑+2H2O
下列说法正确的是( )
| A.KClO3在反应中得到电子 | B.ClO2是氧化产物 |
| C.H2C2O4在反应中被氧化 | D.1 mol KClO3参加反应有2 mol电子转移 |
设 为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 24 镁的原子量最外层电子数为 |
| B. | 1 0.1 乙酸溶液中 数为0.1 |
| C. | 1 甲烷分子所含质子数为10 |
| D. | 标准状况下,22.4 乙醇的分子数为 |
下列实验可行的是()
| A.加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质 |
| B.用NaOH溶液除去CO2中混有的HCl气体 |
| C.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D.用乙醇从碘水中萃取 |
下列实验可行的是()
| A.用澄清石灰水检验CO中含有的CO2 |
| B.用BaCl2除去NaOH溶液中混有的少量Na2SO4 |
| C.用KSCN溶液检验溶液中含有的Fe2+ |
| D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |