现用质量分数为36.5%的浓盐酸(密度为1.19 g/cm3)配制1 mol/L的稀盐酸90 mL。
(1)实验中应选用的仪器是(填序号)____ ____;
①100 mL量筒 ②托盘天平(带砝码) ③玻璃棒 ④50 mL容量瓶
⑤10 mL量筒 ⑥50 mL烧杯 ⑦100 mL容量瓶 ⑧胶头滴管
(2)经计算,需量取浓盐酸的体积为________mL;
(3)此实验中玻璃棒的作用是____________________________;
(4)某学生实际配制稀盐酸的浓度,经滴定测量为0.98 mol/L,原因可能是下列操作中____ ____。
①取用完浓盐酸的量筒未洗涤
②转移溶液后,小烧杯未洗涤
③定容时俯视容量瓶刻度线
④移液前容量瓶内有少量蒸馏水
⑤定容摇匀后液面下降再加水
⑥定容时仰视容量瓶刻度线
配 制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
制200mL0.5 mol·L-1的NaOH溶液,请回答下列问题:
Ⅰ、请将下述实验步骤中缺少的文字请补充完整
(1)实验中选用的仪器除托盘天平、砝码、镊子、量筒、玻璃棒外还必须用到
仪器。
(2)计算:所需NaOH的质量为g;
(3)称量:用托盘天平称量时,首先将托盘天平调平,将 放在天平的左盘上称量其质量,再添上g砝码后,向左盘加NaOH固体到平衡为止;
(4)溶解:向盛有NaOH的烧杯中加入70mL水并用玻璃棒使其溶解;
(5)转移:将步骤(4)中溶液用玻璃棒 注入容量瓶中,在烧杯中加入少量的水,小心洗涤2—3次后并将洗涤液移入容量瓶中 ;
(6)定容:继续往容量瓶中加水至液面接近刻度线 cm处,改用加水至刻度线,注意视线与保持水平,加盖摇匀。
(7)贮存: 将溶液倒入试剂瓶中保存,贴上标签注明溶液的浓度和配制日期。
如下图甲、乙是电化学实验装置。
(1) 若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为____________________________________________;
②将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为____________________________________________。
(2) 若甲、乙两烧杯中均盛有CuSO4溶液。
① 甲中铁棒上的电极反应式为______________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_____(填写物质的化学式)________g。
实验室现有一瓶含少量氯化钙的氯化钾,通过下面的实验制取纯净的氯化钾,根据实
验步骤填写下列空白。
(1)加入的A是,检验A是否过量的方法是。
(2)操作a是,用到的玻璃仪器有、 、 。
(3)溶液中加入的B物质是,应加入过量B物质的理由是。
(4)操作b是,其中用到与操作a相同的玻璃仪器是,该仪器在此处的作用是。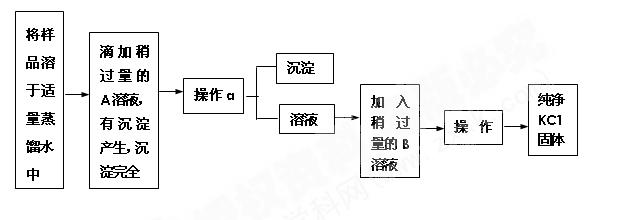
实验室配制100ml 0.2mol/L的NaCl溶液
(1)本实验所需的仪器为(填序号)②
①量筒②托盘天平③烧杯④漏斗⑤250ml 容量瓶⑥ 100ml容量瓶⑦药匙⑧胶头滴管
除上述仪器中可使用的以外,还缺少的仪器。它在该实验中的用途中
①。②。
(2)在使用容量瓶之前必须进行的操作是:在容量瓶中标有①温度,②,③三个特征标志。
(3)请写出该实验的实验步骤。
①计算,②称量,③,④,⑤,⑥定容。
(4)在实验过程中出现如下情况应该该如何处理
①加蒸馏水时不慎超过刻度线应。
②加蒸馏水到刻度线以下1cm至2cm处应
③向容量瓶中倾倒溶液时应
某学生设 计了如下实验:
计了如下实验:
(1)该同学的实验目的是_____________________________;
(2)上图③操作步骤为________________,④加入试剂为;
(3)按此实验方案得到的NaCl固体中肯定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
(4)写出生成C的化学方程式____________________________。