现用Na2CO3固体配制500mL 0.200 mol·L-1的Na2CO3溶液。可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有 (填代号),还缺少的仪器是 (填仪器名称)。
(2)经计算,需Na2CO3固体质量为 。
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol·L-1。请你分析配制过程中可能引起误差偏小的原因 。
A.Na2CO3固体中含结晶水
B.转移时没有洗涤烧杯和玻璃棒
C.配制时容量瓶没有干燥
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2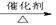 2CH3COOH。
2CH3COOH。
③已知乳酸F的结构简式为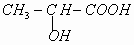 。.
。.
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示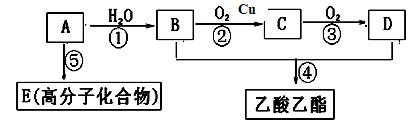
回答下列问题:
(1)E的结构简式为
(2)F分子中含________和_________两种官能团(写名称)
(3)验证D和F兼有的官能团常采用的试剂是,产生的现象为
(4)写出下列反应的反应类型:①,④。
(5)写出下列反应的化学方程式:
①;
②;
③F与金属钠反应的化学方程式为
雷尼镍(RAney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得。
(1)元素第一电离能:AlMg(选填:“>”、“<”、“=”)
(2)雷尼镍催化的一实例为: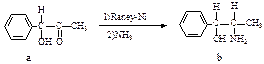
化合物b中除苯环外的C原子、O原子、N原子进行的杂化的形式分别是:、、。
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:(选填序号:a.氯化钠 b. 金刚石 c.石英 d. 氯化铯)。其中心原子配位数为。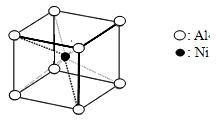
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
①Ni在基态时,核外电子排布式为:。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题: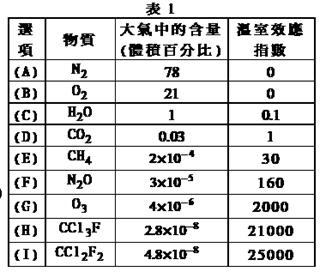
(1)下列由极性键形成的非极性分子是。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手 性异构
性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为。
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为:。
(1)地壳中含量最多的元素基态原子核外未成对电子数为个。
(2)H2O分子内的O-H键、分子间的范德华力和分子间氢键从强到弱依次为。邻羟基苯甲醛比对羟基苯甲醛的沸点(填“低”或“高”),其原因为。
(3)H+可与H2O形成H3O+,H3O+原子采用杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3 ,NA表示阿伏伽德罗常数,则C aO晶胞体积为cm3
aO晶胞体积为cm3
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一 定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。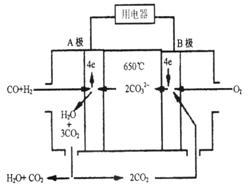
请回答下列问题:
(1)B极发生____(填“氧化”或“还原”)反应
(2)电池总反应为___________________________________________。
(3)以 此电源电
此电源电 解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为g。电解后溶
解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为g。电解后溶 液体积为1 L,溶液的pH约为。
液体积为1 L,溶液的pH约为。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是
(用化学方程式表示)