某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取适量漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝,后褪色 |
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I- + 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献.生产流程如下图:
(1)完成有关反应的化学方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置下图模拟“联合制碱法”的第一步反应.

(3)上述装置中接口连接顺序为 ;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接c D.b接c;a接f、e接d
(4)D中应选用的液体为 。
为测定产品纯碱的成分和含量,做如下实验.假设产品纯碱中只含NaCl、NaHCO3杂质.
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32﹣+H+=HCO3﹣反应的终点),所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL.则纯碱样品中NaHCO3质量分数为 .
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如右图所示。温度高于900℃时,NH3产率下降的原因是 。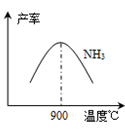
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 。
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是___________;
(2)写出有关离子方程式:
步骤①中生成A:____________;步骤②生成沉淀I:__________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式_____________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________.
[化学——选修有机化学基础]在有机化学中有一种“吉利分子”C8H8O8,“吉利分子”C8H8O8可由图中合成。
已知:①相同条件下,X与H2的相对密度之比为81,其中氧的质量分数约为49.4%,分子中氢氧原子个数比为2∶1,X中没有支链;
②1 mol X在稀硫酸中发生反应生成2 mol甲醇和1 mol A;
③A中含有手性碳原子;
④D能使Br2的CCl4溶液褪色,E为高分子化合物,B为环状结构。
根据上述信息填空:
(1)X的分子式为________,A的分子中含有官能团的名称是______,E的结构简式为________;D若为纯净物,D的核磁共振氢谱存在 种吸收峰,面积比为________;
(2)写出下列反应的化学方程式:
反应②__________________,反应类型:________;
反应④__________________,反应类型:________;
(3)写出B的一种含一个六元环的同分异构体的结构简式:________;
(4)一定量的A物质与乙醇的混合物完全燃烧生成18 g水和V L CO2(标准状况),则该混合物完全燃烧消耗氧气的物质的量为________。