CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下: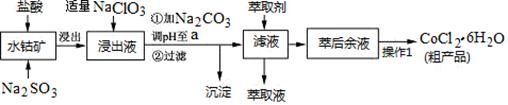
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。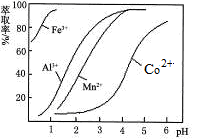
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
写出下列反应的离子方程式:
①锌和稀硫酸制氢气 。
②二氧化碳通入澄清石灰水中 。
煤气化和液化是现代能源工业中重点考虑的能量综合利用方案。最常见的气化方法为用煤生成水煤气,而当前比较流行的液化方法用煤生成CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(g)△H3
则反应CO(g) +2H2(g)=CH3OH(g) 的△H=_______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
①T1和T2温度下平衡常数大小关系是K1____K2(填“>”“<”或“=”)。
②由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为______℃,实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______。
③以下有关该反应的说法正确的是_________(填序号)。
A.恒温、恒容条件下同,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2molCO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%
(3)一定温度下,向2L固定体积的密闭容器中加入1molCH3OH,发生反应:CH3OH(g)  CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
0~2min内的平均反应速率v(CH3OH)= ____________;该温度下,CO(g)+2H2(g) CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
A.平衡常数 B.CH3OH的平衡浓度 C.达到平衡的时间 D.平衡时气体的密度
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=_________________,△H________0(填“<”、“>”或“=”);
②830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.则6s时c(A)为________ mol/L,C的物质的量为_____mol;若反应经过一段时间后,达到平衡时A的转化率为___________,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为_________(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是_________反应(填“吸热”或“放热”);
反应热△H=_______;(用E1、E2表示)
(2)反应体系中加入催化剂对反应热是否有影响? _________,原因是_______________;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______,E2_______(填 “增大”、“减小”或“不变”)。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物:CmHn(烃)、SO2、NOx、CO和C等,请回答下列有关问题:
(1)若用CmHn表示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为________________,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由________能转化为________能,最终转化为机械能;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的__________(填化学式,多填本空不得分)排放;
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式________。