氯化铁广泛应用于污水处理、五金蚀刻及有机工业的催化剂、氧化剂和氯化剂等。
(1)现用mg废铁屑(Fe2O3)制取FeCl3· 6H2O晶体,并测定废铁屑中铁的质量分数,实验装置如图(夹持装置略)。反应开始前至A中固体完全消失时,依次进行下列操作:
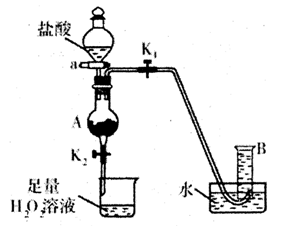
①缓慢滴加足量盐酸
②关闭弹簧夹K1、打开K2并关闭活塞a
③打开弹簧夹K1、关闭K2并打开活塞a
正确的操作顺序是 (填序号);当A中溶液完全进入烧杯后,烧杯中的现象是 ,相应的离子方程式和化学方程式是: 和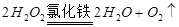 。
。
(2)实验测得B中所得的气体VmL(标准状况),由此计算出该废铁屑中铁的质量分数是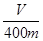 ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是: 。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是: 。
(3)另取mg废铁屑和CO气体在加热时充分反应到恒重,测得实验后剩余固体质量是wg,由此求出铁的准确质量分数是 (用含m和w的式子表示,无需化简)。
氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是。
(2)实验室常用如下图所示装置制取并收集氨气。
①实验室制取氨气反应的化学方程式是。
②图中方框内收集氨气的装置可选用(填字母序号)。
③尾气处理装置中使用倒扣漏斗的作用是。
(3)工业上用NH3制取NO反应的化学方程式是。
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
| 棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
| a |
棉球变白,微热后又恢复红色 |
||
| b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: |
| c |
棉球变为白色 |
该气体具有(选填“氧化性”或“还原性”) |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
(1)步骤②和⑤中都要用到的玻璃仪器是__。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为
滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①下列操作造成测定结果偏高的是(填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
B、用待测定的溶液润洗碱式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a. 滴定操作的正确顺序是(用序号填写)___________________________。
b. 在G操作中如何确定终点? __________________________ ____。
c. 若换酚酞做指示剂,如何确定终点? _________________________ ____。
(2)氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 |
待测液体积 (mL)[来 |
标准KMnO4溶液体积(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
3.00 |
23.00 |
| 第三次 |
25.00 |
4.00 |
24.10 |
①滴定时,KMnO4溶液应装在(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是。
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是(填选项字母)。
| 难溶物 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| Ksp |
1.77×10-10 |
5.35×10-13 |
1.21×10-16 |
1.12×10-12 |
1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g)  NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。
①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①下列选项可以判断该分解反应达到平衡的是________。
A.
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变ΔH______0(填 “>”、“=”或“<”),25.0℃时分解平衡常数的值=__________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将_________(填“增加”,“减少”或“不变”)。
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
(1)A中制备气体时,所需药品是(选填字母序号);
(2)B中盛有饱和碳酸氢钠溶液,其作用是;
(3)写出制取氨气的化学方程式;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式;
(5)检验D出口处是否有氨气逸出的方法是;
(6)写出制纳米级碳酸钙的化学方程式。
(7)若实验过程中有氨气逸出,应选用下列装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
试回答:
(1)所加试剂A的化学式为
(2)B操作方法是
(3)样品中氯化铵的质量分数为。