氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步 具有极其重要的意义。
I.某化学兴趣小组为探究Ag+和Fe3+氧化性,设计了如下实验:
第一步:将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。
第二步:为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水。请完成下表:
| 操 作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加人KSCN溶液,振荡 |
(1) |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 (2) ,振荡 |
(3) |
存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+,氧化性:Ag+ Fe3+(填“大于”或“小于”)。
Ⅱ.生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
(1)NaCl和Cl2中化学键的类型分别是 和 。
(2)燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
Ⅲ.将32 g铜与l40 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H2O2的质量为 g。
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
(1)写出步骤①、②、④分离提纯的方法:
①; ②; ④。
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、溶液、溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应。向所得溶液中滴加至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论。
(5)写出加入试剂a后,发生反应的离子方程式。
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和石灰乳制取漂白粉的化学方程式 ________________________________________________。
除去下列物质中的杂质(括号内代表杂质),请写出相应的实验方法或试剂名称及有关反应的化学方程式。
(1)NaCl溶液(Na2CO3) 试剂____________,反应的化学方程式__________________________;
(2)NaHCO3溶液(Na2CO3) 试剂____________,反应的化学方程式___________________________;(3)Na2CO3固体(NaHCO3)实验方法____________,反应的化学方程式_____________________;
(4)铁粉(铝粉)试剂______________,反应的化学方程式__________________________。
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W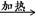 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑
④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W:________、X:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:①离子方程式:__________________________。②化学方程式:_______________________。
常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c (HA) = c (NaOH) =0.lmol/L,测得混合后溶液的pH>7。
①不能证明HA是弱电解质的方法是()
A.测得0. 1mol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
②混合溶液中,关系式一定正确的是()
A.c(A-)>c(Na+)>c(OH-)>c(H+)
B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L
D.c( HA) +c( H+)=c(OH-)
③若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,则相同pH的①NaA溶液;②Na2B溶液;③NaHB溶液;④NaC溶液,其物质的量浓度由大到小的顺序为(填序号)。
(2)若c( HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为mol/L。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)= 0.04 mol/L,c(NaOH)=0.02 mol/L。
①若HA为CH3COOH,二者等体积混合后该溶液显酸性,则溶液中所有离子按浓度由大到小排列的顺序是。
②若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为_ _mol/L(假设混合后溶液体积为两溶液体积之和)。
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) |
360 |
440 |
520 |
| K值 |
0.036 |
0.010 |
0.0038 |
(1)①写出工业合成氨的化学方程式_________________________________________。
②由上表数据可知该反应为放热反应,理由是_____________________________________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g) CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的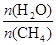 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: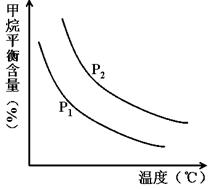
①图中,两条曲线表示压强的关系是:P1________P2(填“>”、“=”或“<”)。
②该反应为_____________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g) CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为______,该温度下反应的平衡常数K值为_________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6