分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、SO2、NOx等,其主要来源为燃煤和机动车尾气排放等。
(1)某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:

① 该实验能确认存在的阳离子是 。
② 该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③ 根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)燃煤厂为减少SO2的排放,可采取的措施是:
① 洗涤含SO2的烟气,下列物质可作洗涤剂的是______。
a.浓NH3∙H2O b.NaHCO3 c.FeCl3 d.NaHSO3
② 将煤转化为清洁气体燃料,过程如图所示:

已知:反应①生成1molCO(g)的反应热△H= -110.5KJ/mol反应②生成1molH2O(g)的反应热△H= -241.6KJ/mol焦炭与水蒸气反应的热化学方程式是________________。
(3) 汽车尾气处理系统可将CO和NO转化成无毒物质,其化学反应方程式是________________
(4)为将CO和NO转化为无毒物质,某同学设计了如图装置。

①电极a是________极;
②甲的化学式是 ;
③电极b的电极反应式是____________。
下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
试回答下列问题: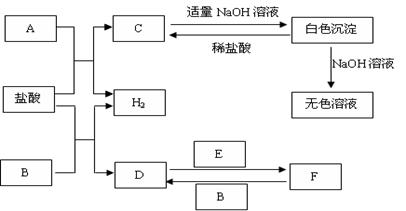
(1)A在周期表中的位置是;
(2)检验F中金属阳离子的常用方法是。
(3)白色沉淀与NaOH溶液反应的离子方程式是。
(4)反应F→D的化学方程式是。
(1)材料是人类赖以生存和发展的重要物质基础。
①生产水泥的主要原料是黏土和(填名称)。
②橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施可增大强度和弹性,硫化后的橡胶是结构。(选填“线型”或“体型”)。
(2)人体健康与食品关系密切。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取(选填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②生活中应合理地摄取人体必需的元素,体内元素含量过低,会引起甲状腺疾病。
③糖类、油脂、蛋白质都是人体必需的营养物质。其中蛋白质被摄入人体后,在酶的作用下水解为(写名称)。
(3)人体健康与药物等关系密切:
人的纯净胃液是一种无色液体,呈酸性,PH在0.9~1.5之间,其中H+的浓度比血液中高几万倍,回答下列问题:
①液有帮助人体消化食物等多种功能,胃酸的主要成份是
②若胃酸酸度增大就会患胃酸过多症,下列物质不宜用做治疗胃酸过多的药物是
| A.小苏打 | B.氢氧化铝 | C.氢氧化钠 | D.碳酸镁 |
③胃舒平的主要成份是氢氧化铝,不溶于水且作用持久,写出该药物中和胃酸的离子方程式。
④可以帮助流感病人解热镇痛的药物是(选填“青霉素”或“阿司匹林”)。
(4)洁净安全的生存环境更是健康的保障。
①某农村地区洪涝灾害后为获得饮用水,在将地表水取回家后,先加明矾,再过滤,去除悬浮在水中的较大颗粒;过滤后常使用漂白粉进行杀菌消毒,
其原理可用化学方程式表示为。
②氯气与氢氧化钙溶液反应能制得漂白粉。试写出工业制漂白粉反应的化学方程式:。
③通道口设有专门垃圾箱,箱体上标有下图所示,下图图标表示 。
向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图所示。试回答: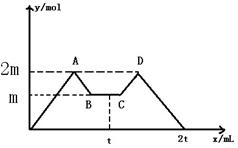
(1)AB段所表示的反应的离子方程式是;
CD段所表示的反应的离子方程式是。
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是。
(3)a是______________,且c(a)∶c(b)=_______________
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)= _____________________
_____________________
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。
试通过计算确定400℃剩余固体成分的化学式。(写出计算过程)
“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请回答下列问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
①写出步骤I的化学方程式:__________________________________________________。
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是_________________。
③下列有关硅材料的说法正确的是 ( )
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
④在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是_______(填字母)。
A.高温结构陶瓷B.生物陶瓷C.导电陶瓷
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。下列物质中不属于合金的是( )
A.钢铁B.青铜C.硬铝D.水银
(3)高分子材料。它可以分成无机高分子材料和有机高分子材料。[Al Fe (OH)n Cl6-n]m属于无机高分子材料,是一种新型高效净水剂,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为______;
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66g白色沉淀。过滤,在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20g固体。
①该磁性粉末中氧元素的质量分数为________;
②该材料的化学式为___________________。
H2O2是重要的化学试剂,在实验室和生产实际中应用广泛。
(1)H2O2不稳定,其生产过程要严格避免混入Fe2+和Fe3+,否则会发生如下两个反应,加快其分解,且Fe2+和Fe3+各自的量保持不变。
①2Fe2+ + H2O2 + 2H+=2Fe3+ + 2H2O
②(填离子方程式)。
(2)H2O2的水溶液显弱酸性,写出一个用盐酸制取H2O2的化学方程式__________________。
(3)H2O2在使用中通常不会带来污染。
①工业上利用Cl2 + H2O2 =" 2HCl" + O2除氯,在此反应中被氧化的物质是______________。
②消除某废液中的氰化物(含CN-),完成下列反应:
CN- + H2O2 + H2O=____________ + NH3↑
(4)实验室常用酸性KMnO4溶液测定H2O2的浓度。
取10.00 mL H2O2溶液样品(密度近似为1g/mL)于锥形瓶中,加水到50.00 mL,当滴入0.10 mol/L KMnO4 溶液40.00 mL后,恰好完全反应。则原样品中H2O2的质量分数是_______________。