焦亚硫酸钠(NA2S2O5)是常用的食品抗氧化剂之一,易被氧化为硫酸钠。某研究小组进行如下实验:采用下图装置(实验前已除尽装置内的空气)制取NA2S2O5。装置II中有NA2S2O5晶体析出,发生的反应为:NA2SO3+SO2=NA2S2O5
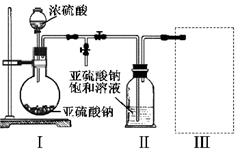
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
(4)NA2S2O5溶于水即生成NAHSO3。证明NAHSO3溶液中HSO3-的电离程度大于水解程度,可采用的方法是 (填序号)。
| A.测定溶液的pH |
| B.加入BA(OH)2溶液 |
| C.加入盐酸 |
| D.加入品红溶液 |
E.用蓝色石蕊试纸检测
(5)检验NA2S2O5晶体在空气中已被氧化的实验方案是 。
(6)葡萄酒常用NA2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
【2015北京理综化学】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。
①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
【2015广东理综化学】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
(1)煅粉主要含MgO和 ,用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶, 若溶液I中c(Mg2+)小于5×10-6mol·L-1,则溶液pH大于 (Mg(OH)2的Ksp=5×10-12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
(5)一种可超快充电的新型铝电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 。
【2015安徽理综化学】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2==□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。
【2015福建理综化学】(15分)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
FeCl2 |
| 沸点/℃ |
57.6 |
180(升华) |
300(升华) |
1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 。
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)ΔH1="+1344.1kJ" ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)ΔH2="+1169.2kJ" ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_______。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
【2015山东理综化学】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯b.容量瓶c.玻璃棒 d.滴定管
(2)
| Ca2+ |
Mg2+ |
Fe3+ |
|
| 开始沉淀时的pH |
11.9 |
9.1 |
1.9 |
| 完全沉淀时的pH |
13.9 |
11.1 |
3.2 |
加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤Ⅰ:移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。