七铝十二钙(12CaO•7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)煅粉主要含MgO和 ;用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1)Ca原子结构示意图。
(2)Ca与最活跃的非金属元素A形成化合物D,D的沸点比A与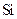 形成的化合物E的沸点(填高或低),用电子式表示D的形成过程。
形成的化合物E的沸点(填高或低),用电子式表示D的形成过程。
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则M位于元素周期表中的位置是: 。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3g.
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1) L的轨道表示式为________;
(2)五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(3)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子空间构型为____________,A的电子式为____________,B的结构式为____________。
(4) 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层。该族2-- 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1
c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(5)工业上常用电解M2L3的方法来制取M单质。当制得54克M单质时,转移电子的物质的量是___________ mol
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Y的元素符号是 。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。此反应的化学方程式是 。
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:__________________________________。
A+,B2+,C-离子都由1~18号中某些元素组成。A+离子中键角为109°28',B2+离子中没有化学键。C-离子中有9个质子,具直线型结构。已知A+,B2+,C-均有10个电子。试回答
(1)写出离子符号:A+______,B2+______,C-______。
(2)下列微粒:Ca2+,Ag+,质子,中子,哪些最易与C-结合为挥发性稳定化合物______