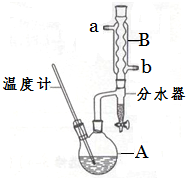
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下
(CH3CH2CH2CH2)2O + H2O。反应物和产物的相关数据如下
| |
相对分子质量 |
沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
| 正丁醇 |
74 |
117.2 |
0.8109 |
微溶 |
| 正丁醚 |
130 |
142.0 |
0.7704 |
几乎不溶 |
合成反应:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振荡后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振荡后静置,粗产物应从分液漏斗的 (填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
a.100℃ b. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 。(保留两位有效数字)
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是。
(2)哪一段时段的反应速率最小,原因是。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
| A.蒸馏水 | B.NaCl溶液 | C.Na2CO3溶液 | D.CuSO4溶液 |
你认为可行的是(填编号)。
(9分)已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平② 。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。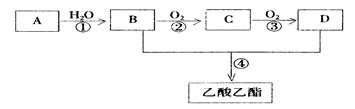
回答下列问题:
(1)B、D分子中的官能团名称分别是、。
(2)写出下列反应的反应类型:①,②,④。
(3)写出下列反应的化学方程式:
②;④。
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题: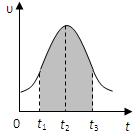
(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是:,
(3)t2→t时间段内反应速率减小的原因是:,
(4)图中阴影部分“面积”表示t1→t3时间里。
A.Mn2+物质的量浓度的增大B.Mn2+物质的量的增加
C.SO42-物质的量浓度D.MnO4-物质的量浓度的减小
II.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如上图甲可观察,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。
①放出V/3 mL气体时所需时间为min。
②该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为>>>
(14分) 某小组准备在实验室中制取干燥、纯净的氯气并验证氯气的性质,设计了如下的实验装置图:
(一) 制取纯净的氯气
(1)写出A中反应的化学方程式:____________________________________.
(2)B中加入的物质是:___________________作用是:___________________.
(3)C中加入的物质是:___________________作用是:___________________.
(4)E中反应方程式为:_____________________________________________.
(二) 验证氯气的性质: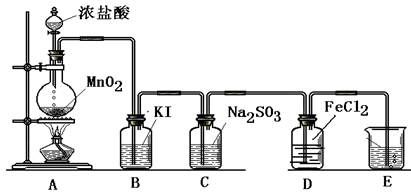
(5)B中发生反应的方程式为:_______________________________________.
(6)C中发生反应的方程式为:______________________________________.
(7)D中的反应方程式为:__________________________________________.
从今年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从绍兴、宁波、台州地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素。
I.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为40 mg/kg,要达到上述碘含量要求,需服用该碘盐kg,你觉得服用碘盐防辐射合理吗?
II.如图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移
至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 |
碱式滴定管读数 |
消耗体积(mL) |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
0 |
如图一 |
|
| 2 |
0 |
23.98 |
23.98 |
| 3 |
0 |
24.02 |
24.02 |
(1)第一次读数为mL。
(2)滴定终点的判断方法。
(3)经过计算,此加碘盐碘元素的含量为mg/kg(用包含a、b的最简表达式表示)。
(4)下列操作可能会导致测量结果偏低的是。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |