六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同。下列判断正确的是
A.A、C两种元素只能组成化学式为CA3的化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是E>F>C>D
D.元素的非金属性由强到弱的顺序是D>C>F>B
常温下,对化学式满足CnH2n—2的某气态链烃,下列说法不正确的是
| A.肯定是不饱和烃 | B.肯定能使酸性高锰酸钾溶液褪色 |
| C.可能是乙烯的同系物 | D.可能是炔烃 |
下列分子式只能表示一种物质的是
| A.C3H4Cl2 | B.C3H8 | C.C2H6O | D.C6H6 |
下列变化属于化学变化的是
①钝化②煤的气化③煤的干馏④石油的裂化⑤石油的分馏
| A.全是 | B.除②③外 | C.除②⑤外 | D.除⑤外 |
向m g镁、铜合金中加入稀硝酸溶液至合金恰好完全溶解(设硝酸的还原产物只有NO),向所得溶液中加入物质的量浓度为2 mol/L的NaOH溶液至沉淀达到最大值,产生沉淀的质量为(m + n)g,则下列有关叙述中不正确的是
| A.若n=5.1,则m的值可能为9.8 |
| B.若n=5.1,则参加反应的硝酸的物质的量为0.4 mol |
| C.若n=5.1,则加入的NaOH溶液的体积为150 mL |
D.若n =5.1,则被还原的硝酸的物质的量为0.1 mol =5.1,则被还原的硝酸的物质的量为0.1 mol |
2010年1月份以来,海南豇豆在武汉白沙洲农副产品市场连续三次被检测出含有禁用农药水胺硫磷。水胺硫磷的结构如下,下列有关该物质的性质描述不正确的是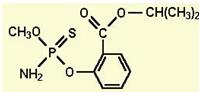
| A.该物质不溶于水,能溶于乙醚、苯、丙酮等有机溶剂 |
| B.该物质能发生取代反应、加成反应 |
| C.该物质能与NaOH溶液反应,每1mol该物质最多消耗3mol NaOH |
| D.该物质苯环上的一卤代物共有4种 |