铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。
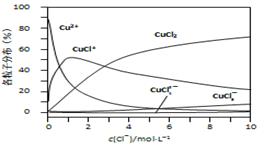
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
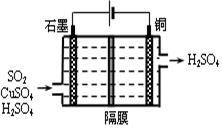
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
②利用上图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式: ;
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a.NH3 b.HI c.SO2d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
(6分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
试用 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是 ;
(2)写出电极反应式:
负极: ,
正极: ;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
由原子序数依次增大的五种短周期元素A、B、C、D、E,已知A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素最高价氧化物的水化物与其氢化物反应生成一种盐;A、B、C、E四种元素分别都能与D元素形成原子个数比不相同的多种常见化合物,回答下列问题:
(1)B在周期表中的位置是 ,C元素的单质的电子式 。
(2)写出同时含A、B、C、D四种元素的一种盐的化学式 。
(3)E与D形成的一种化合物与BD2发生氧化还原反应,该反应的化学方程式为 。
(4)用A和D两元素组成的单质可以制成一种燃料电池,电池中装有浓KOH溶液。用多孔的惰性电极浸入浓KOH溶液中,两极均有特制的防止气体透过的隔膜,在一极通入A的单质,另一极通入D的单质。则该电池正极的电极反应式为 。
(5)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。已知1mol C2A4和C2D4完全反应生成两种气体时放出热量516.8KJ,则该反应的热化学方程式为 。
从能量的变化和反应的快慢等角度研究反应: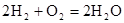 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.适当提高氧气的浓度 |
| C.适当提高反应的温度 | D.适当降低反应的温度 |
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。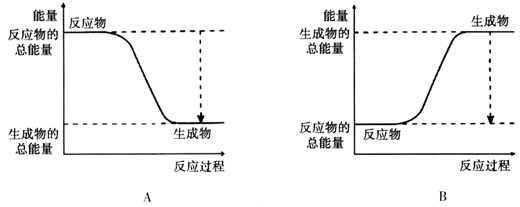
(3)从断键和成键的角度分析上述反应中能量的变化。
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
| 化学键 |
H—H |
O=O |
H—O |
键能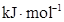 |
436 |
496 |
463 |
请填写下表:
| 化学键 |
填“吸收热量” 或“放出热量” |
能量变化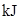 |
|
| 拆开化学键 |
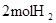 中的化学键 中的化学键 |
_______________ |
_______________ |
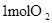 中的化学键 中的化学键 |
|||
| 形成化学键 |
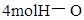 键 键 |
_______________ |
_______________ |
| 总能量变化 |
_______________ |
_______________ |
|
(4)氢氧燃料电池的总反应方程式为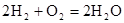 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。