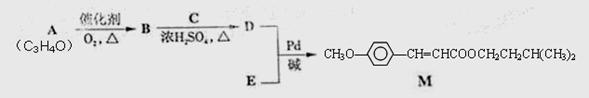
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
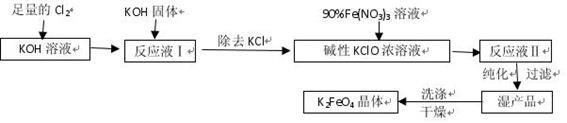
已知:① 2KOH + Cl2=" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2=" 5KCl" + KClO3+ 3H2O(条件:温度较高)
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)在“反应液I”中加KOH固体的目的是 :
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
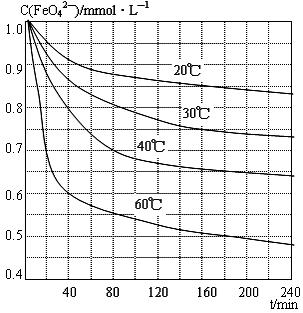
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
( 12分)Ⅰ.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
2SO3(g)2min末测得容器中有7.2mol SO2。试回答:
①反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③用O2的浓度变化表示该时间段内的化学反应速率_______________________。
Ⅱ.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |
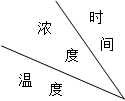 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
C2 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 3 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,C2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
(3) 如果2A (g) B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5; D的单质跟盐酸反应,生成D3+和氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①写出元素符号:
A,C,E。
② B、D的最高价氧化物对应水化物相互反应的离子方程式为:
。
③写出E2C的电子式:。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。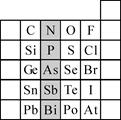
①阴影部分元素N在元素周期表中的位置为第周期第族。
根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③ Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
(12分) Ⅰ.下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。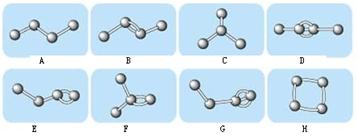
(1)图中属于烷烃的是(填编号)属于烯烃的是,(填编号)
(2)上图中与B互为同分异构体但不属于同种类的物质的是:。(填编号)
Ⅱ.课本“交流•研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收249kJ的能量;形成水分子中1 mol H—O键能够释放463kJ能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。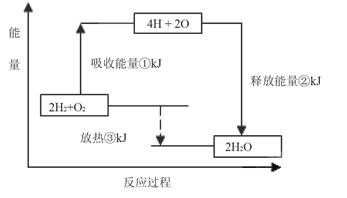
①kJ②kJ③kJ
已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),另一个产物A也呈酸性,反应方程式如下:
C6H5CHO(苯甲醛)+(CH3CO)2O → C6H5CH=CHCOOH(肉桂酸)+ A
(1)上述反应式中,反应物的物质的量之比为1︰1。产物A的名称是。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其结构简式为______________关于它的说法正确的是。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.在酸性或碱性条件下可以水解 d.属于芳香烃的衍生物
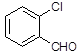
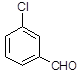
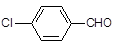
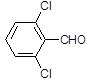
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
| 取代苯甲醛 |
 |
 |
 |
 |
| 产率(%) |
71 |
63 |
52 |
82 |
可见,取代基对Perkin反应的影响有(写出2条即可):
①____________________________________②__________________________________。
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氮化钯催化下可直接合成肉桂酸乙酯,该反应属于Heck反应,是环B的一种取代反应,其反应方程式为
(不要求标出反应条件)________________________________________________
(5)Heck反应中,为了促进反应的进行,通常可加入一种显(填字母)的物质,原因是__________________________________________________________________。
A.弱酸性 B.弱碱性 C.中性 D.强酸性
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。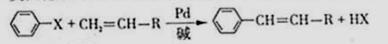 (X为卤原子)
(X为卤原子)
经由Heck反应合成M(一种防晒剂)的路线如下:
|