下列反应方程式不正确的是
A.工业上制取粗硅的化学方程式:SiO2+2C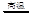 Si+2CO↑ Si+2CO↑ |
B.硫酸型酸雨的形成会涉及反应2H2SO3 +O2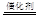 2H2SO4 2H2SO4 |
| C.Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
| D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32- |
下列反应中,属于取代反应的是
A.CH4 + 2 O2 CO2 + 2H2O CO2 + 2H2O |
B.CH2=CH2 + H2 CH3-CH3 CH3-CH3 |
C. + Br2 + Br2   + HBr + HBr |
| D.2CH3CH2OH + O2 2CH3CHO + 2 H2O |
在一定条件下,密闭容器中可发生可逆反应:N2(g) + 3H2(g)  2NH3(g) 。
2NH3(g) 。
下列说法中,表明这一反应已经达到化学平衡状态的是
| A.N2、H2、NH3的浓度相等 | B.N2、H2、NH3的浓度不再变化 |
| C.N2、H2、NH3在密闭容器中共存 | D.反应停止,正、逆反应速率都等于零 |
X、Y均为短周期元素,X原子的最外层有2个电子,Y原子的最外层有7个电子,这两种元素形成化合物的化学式是
| A.XY | B.XY2 | C.X2Y | D.X2Y3 |
下列各组物质中,属于同分异构体的是
A. 与 与 |
B. 和 和 |
| C.淀粉与纤维素 | D. 与 与 |
为了保护臭氧层,可采取的有效措施是
| A.减少二氧化硫的排放量 | B.减少含铅废气的排放量 |
| C.减少氟氯代烃的排放量 | D.减少二氧化碳的排放量 |