下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是
| A.2NaOH + H2SO4 = Na2SO4 + 2H2O |
| B.Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O |
| C.Ba(OH)2 + 2HCl = BaCl2 + 2H2O |
| D.KOH + HCl =" KCL" + H2O |
可用右图装置制取和收集的气体是
| A.锌与稀硫酸反应制H2 |
| B.浓盐酸与二氧化锰反应制Cl2 |
| C.过氧化氢溶液与二氧化锰反应制O2 |
| D.电石与饱和食盐水反应制C2H2 |
用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是
| A.AlCl3 | B.Na2CO3 | C.Na2SO3 | D.KMnO4 |
以下性质的比较中,正确的是
| A.熔点:CBr4> CCl4>CF4 | B.热稳定性:HCl> H2S > H2O |
| C.原子半径:Cl> O>N | D.密度:苯>水>四氯化碳 |
以下物质的制备原理错误的是
A.无水氯化镁的制备:MgCl2·6H2O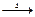 MgCl2+6H2O MgCl2+6H2O |
B.钴的制备:3Co3O4+8Al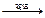 9Co+4Al2O3 9Co+4Al2O3 |
C.烧碱的制备:2NaCl+2H2O 2NaOH +H2↑+ Cl2↑ 2NaOH +H2↑+ Cl2↑ |
| D.漂粉精的制备: 2Ca(OH)2 + 2Cl2→Ca(ClO)2+CaCl2+2H2O |
下列叙述中,能证明某物质是弱电解质的是
| A.熔化时不导电 | B.水溶液的导电能力很差 |
| C.属于共价化合物 | D.溶液中已电离的离子和未电离的分子共存 |