A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
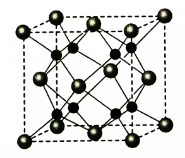
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
在一定体积的密闭容器中进行化学反应:CO2 (g)+H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度的关系如下表所示:
CO(g) + H2O(g),其化学平衡常数K和温度的关系如下表所示:
| t/ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0. 9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________。
(2)该反应为___________反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c (CO2)·c (H2) =" c" (CO) ·c (H2O),试判断此时的温度为_______
(4)能判断该反应是否达到化学平衡状态的依据是()
A.容器中物质的量不变
B.混合气体中各物质的浓度不变
C.消耗nmolCO2的同时,生成了2nmolH2
D.c (CO2) =" c" (H2O)
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
2SO3 ΔH <0。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改用效率更高的催化剂d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)为____________。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀___________克?
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。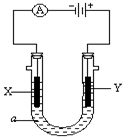
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 ,电极反应式是 。
(3)此装置若是在某金属上电镀铜,则①X电极的材料是 ,②Y电极的材料是 ,电解液a选用 溶液
已知:2H2(g)+ O2(g)=2H2O(g) △H=" -484" kJ/mol,2H2(g)+ O2(g)=2H2O(l)△H= -572kJ/mol,若在标准状况下H2和O2组成的混合气体点燃,爆炸后再恢复到标准状况,生成液态水18克,则反应放出的热量是____________kJ。将0.3moL的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出660kJ热量,该反应的热化学方程式为_______________又已知:H2O(l)=H2O(g) △H=+44kJ/mol,则2.24L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
I.写出下列物质溶于水的电离方程式:
(1)HCl: ,(2)Ba(OH)2: ,
(3)NaHCO3: ,(4)NaHSO4: 。
Ⅱ.试用质子数、中子数、电子数、质量数和同位素填空:
(1)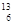 C与
C与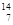 N具有相同的 (2)
N具有相同的 (2)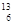 C与
C与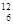 C具有相同的
C具有相同的
(3)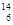 C与
C与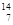 N具有相同的 (4)
N具有相同的 (4)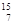 N与
N与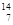 N互为
N互为
Ⅲ.用“相等”或“不相等”填空:
0.3 mol的氧气和0.2 mol的臭氧(O3),它们的质量 ,它们所含的分子数 ,原子数 。