下列说法正确的是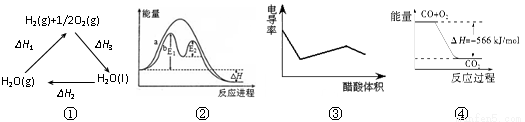
| A.图①中△H1=△H2+△H3 |
| B.图②在催化剂条件下,反应的活化能等于E1+E2 |
| C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 |
| D.图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附。取一块制作炭雕的下脚料,进行下面的实验。下列有关叙述不正确的是( )
| A.将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体 |
| B.将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色 |
| C.将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体 |
| D.将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应 |
发现新材料是现代科技发展的方向之一。下列有关材料的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②新型合金材料的硬度比成分金属大,熔点比成分金属高
③高纯度的硅单质广泛用于制作光导纤维
④生铁和钢都可以完全溶解于足量的盐酸中
⑤氮化硅陶瓷属于新型无机非金属材料
| A.①② | B.②③ | C.①⑤ | D.①③④ |
下列说法不正确的是( )
| A.人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| B.太阳能电池可利用硅材料制作,其应用有利于节能环保 |
| C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解除去 |
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是( )
符合图中阴影部分的物质是( )
| A.Na2CO3 | B.Cu2(OH)2CO3 | C.NaCl | D.NaHCO3 |