氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得。实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75∶2);②在碳存在下,X与N2反应生成AlN。请回答:
(1)X的化学式为 。
(2)碳热还原制备氮化铝的总反应化学方程式为:
Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)
2AlN(s)+3CO(g)
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如下图曲线甲所示。下列说法不正确的是 。

A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
B.c点切线的斜率表示该化学反应在t时刻的瞬时速率
C.在不同时刻都存在关系:v(N2)=3v(CO)
D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
②一定温度下,在压强为p的反应体系中,平衡时N2的转化率为α,CO的物质的量
浓度为c;若温度不变,反应体系的压强减小为0.5p,则N2的平衡转化率将 α (填“<”、“=”或“>”),平衡时CO的物质的量浓度
A.小于0.5c B.大于0.5c,小于c
C.等于c D.大于c
③该反应只有在高温下才能自发进行,则随着温度升高,反应物Al2O3的平衡转化率将 (填“增大”、 “不变”或“减小”),理由是 。
(3)在氮化铝中加入氢氧化钠溶液,加热,吸收产生的氨气,进一步通过酸碱滴定法可以测定氮化铝产品中氮的含量。写出上述过程中氮化铝与氢氧化钠溶液反应的化学方程式 。
某二元酸(化学式用H2B表示)在水中的电离方程式H2B=H++HB-;HB- H++B2-回答下列问题:
H++B2-回答下列问题:
(1)Na2B溶液显______(填“酸性”,“中性”,或“碱性”)。理由是___________(用离子方程式表示)。
(2)在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中氢离子的物质的量浓度可能是____0.11 mol/L(填“<”、“>”、“=”)理由是: 。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是_____________。
(1)常温下,0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则
①混合溶液中由水电离出的c(H+) (填“>”、“<” 或“=”)原HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。c(Cl-)-c(M+)= mol·L-1;
(2)常温下,若将0.2 mol·L-1MOH溶液与0.1 mol·L-1HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下,MOH的电离程度 (填“大于”、“小于”或“等于”) MCl的水解程度。
(3)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH (填“>7”或“< 7”或“无法确定”)。
(4)AgNO3的水溶液呈 (填“酸”、“中”或“碱”)性,原因是(用离子方程式表示) ;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。
(5)把FeCl3溶液蒸干、灼烧,最后得到的固体产物主要是 。
在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)。下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
cZ(g)。下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。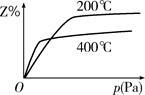
(1)写出该反应的化学平衡常数表达式:K=________。随着温度的升高,K值________(填“增大”“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明________(填字母)。
| A.X的转化率越高 |
| B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 |
| D.化学反应速率越快 |
(2)如图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲、乙两容器的初始体积均为1L。甲、乙容器达到平衡所用时间:甲________乙(填“>”“<”或“=”,下同),平衡时X和Y的转化率:甲________乙。
在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应: 2A(g)+B(g)  3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
①2分钟内用B表示的平均反应速度为 ;
②若容器温度升高,平衡时混合气体的平均摩尔质量减小,则正反应为 (填 “吸热”或“放热”)反应。
肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式______________________。
(2)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为_______________________________。