下列的离子方程式正确的是
| A.用大理石跟稀盐酸制二氧化碳:CO32—+2H+==H2O+CO2↑ |
| B.向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+= BaSO4↓ |
| C.硫酸溶液中加入Mg (OH)2:2H++ Mg(OH)2==Mg2+ +2H2O |
| D.铁与稀盐酸反应:Fe +6H+ ==2Fe3+ +3H2↑ |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是 ( )
| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲=V乙 |
| D.电极反应式:甲中阴极为Cu2++2e-=Cu,乙中负极为Mg-2e-=Mg2+ |
下列反应中,Q2>Q1的是 ( )
| A.H2(g)+F2(g)=2HF(g) ΔH=-Q1 kJ·mol-1 H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH=-Q1 kJ·mol-1 2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 kJ·mol-1 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-Q1 kJ·mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-Q2 kJ·mol-1 |
| D.S(s)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1 |
S(g)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
蝇类昆虫的雌性信息素可用芥酸(来自白芥)与羧酸X在浓NaOH溶液中进行阳极氧化得到。电解总反应式为
C21H41COOH芥酸+X+4NaOH―→C23H46(雌性信息素)+2Na2CO3+2H2O+H2↑
则下列说法正确的是 ( )
| A.X为C3H7COOH |
| B.电解的阳极反应式为C21H41COOH+X-2e-+2H2O=C23H46+CO32—+6H+ |
| C.电解过程中阴极区pH增大,Na+向阴极移动 |
| D.阴极的还原产物为H2和OH- |
Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2 Li+2SO2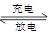 Li2S2O4。下列说法正确的是 ( )
Li2S2O4。下列说法正确的是 ( )
| A.该电池反应为可逆反应 |
| B.放电时,Li+向负极移动 |
| C.充电时,阴极反应式为Li++e-=Li |
| D.该电池的电解质溶液可以换成LiBr的水溶液 |
根据下图回答,下列说法不正确的是 ( )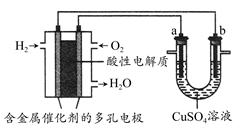
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.燃料电池中正极反应为O2+4e-+4H+=2H2O |
| C.若a为粗铜,b为纯铜,该装置可用于粗铜的精炼 |
| D.电子经导线流入a电极 |