反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是
下列有关苯酚的实验事实中,能说明侧链对苯环性质有影响的是
| A.苯酚与浓溴水反应生成三溴苯酚 | B.苯酚能和NaOH溶液反应 |
| C.苯酚燃烧产生带浓烟的火焰 | D.1mol苯酚与3mol H2发生加成反应 |
某种烃与H2 1∶1加成后的产物如右图所示:则该烃的结构式可能有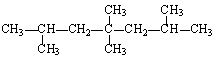
则该烯烃的结构
| A.2种 | B.3种 | C.4种 | D.6种 |
下列各对物质中,互为同系物的是
A.CH3-CH=CH2与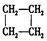 |
B.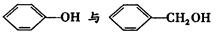 |
| C.甲苯和二甲苯 |
D.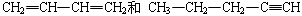 |
下列各化合物的命名中正确的是
| A.CH2=CH-CH=CH2 1,3—二丁烯 | B.CH3 –O –CH3乙醚 |
C.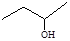 3―丁醇 3―丁醇 |
D.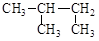 2―甲基丁烷 2―甲基丁烷 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是
| A.蒸馏可用于分离提纯液态有机混合物 |
| B.燃烧法是研究确定有机物成分的一种有效方法 |
| C.核磁共振氢普通常用于分析有机物的相对分子质量 |
| D.对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |