人早晨不吃早餐,血糖会降低。一个人早晨吃了一个馒头,现从此人的消化道中取一些液体。
(1)对液体进行一些处理后,加入银氨溶液,在合适的条件下,产生了银镜现象,能否说明淀粉已完全水解?为什么?___________________
(2)如果反应需要1 mol银氨离子,则反应消耗了________mol葡萄糖
下表是周期表中的一部分,根据元素A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
Bm] |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,氧化性最强的单质是, (2)最高价氧化物的水化物碱性最强的是,酸性最强的是;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是;
(4)在B、C、D、E、F、G、H中,原子半径最大的是.
离子半径最大的是.写出AEH形成的一种盐(化肥)的电子式.
.有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(一)苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;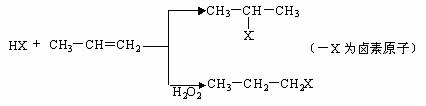
(二)工业上利用上述信息,按下列路线合成结构简式为的物质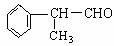 ,该物质是氢化阿托醛一种香料。
,该物质是氢化阿托醛一种香料。
请根据上述路线,回答下列问题:
(1)A为一氯代物,它的结构简式可能为_______________________________________。
(2)工业生产过程中,中间产物必须经过②③④得到D,而不采取直接转化为D的方法原因是_____________________________________。
(3)写出反应类型②_________、③_________。
(4)反应④的化学方程式为:__________________________________________。
(5)氢化阿托醛与氢气1:1加成后的产物C9H10O的同分异构体很多,写出两种符合下列三个条件的 C9H10O的同分异构体的结构简式:__________________、___________________。
①能与溴水反应
②能与氢氧化钠溶液反应
③分子中只有苯环一种环状结构,苯环上有两个取代基,且苯环上的一溴代物有两种;
(6)氢化阿托醛发生银镜反应的化学方程式为_____________________________________。
(12分)据《中国制药》报道,化合物F是用于制备“非典”药品(盐酸祛炎痛)的中间产物,其合成路线为:
已知:(Ⅰ)RNH2+R/CH2Cl  RNHCH2 R/+HCl(R和R/代表烃基)
RNHCH2 R/+HCl(R和R/代表烃基)
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ)
(苯胺,弱碱性,易氧化)
(Ⅳ) 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物。
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物。
回答下列问题:
(1)反应①的条件是_______________________________
(2)反应③和反应④的顺序不能颠倒,原因是_____________________________________
(3)C的结构简式是_________________。
(4)D+E→F的化学方程式:_____________________。
(5)反应①~⑤中,属于取代反应的是(填反应序号)_______________ 。
.奶油中有一种只含C、H、O的化合物A。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1。
(1)A的分子式为______________。
(2)写出与A分子式相同的酯的同分异构体有________________种。
已知:①A中含有碳氧双键,A既不是羧酸也不是酯
②G的一氯代物只有一种
③
 RCHO+R´CHO
RCHO+R´CHO
与A相关的反应如下:
(3)A中含有的官能团为_____________________
(4)写出A→G、B→D的反应类型分别为: ____________、 ______________。
(5)写出A、C、G的结构简式:A________________________、C_______________________、F____________________。
(6)写出E→F反应的化学方程式_____________________________________________。
. 已知:A、B、C、D均为芳香族化合物,且式量B>A>C,已知有机物A的结构简式为:
(1) A既能与NaOH溶液反应,又能与NaHCO3溶液反应,1mol A和过量NaHCO3溶液反应生成CO2_________mol。
(2) 有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯如图。写出B的结构简式_________________。
等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为_______________________。
(3) 1molA、C完全燃烧,消耗氧气的质量相等,且1molC能和1molNa完全反应,写出含碳原子数最少的C的结构简式为_____________________________。