在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:2NO2(g)  N2O4(g) ΔH <0
N2O4(g) ΔH <0
| 容器 |
物质 |
起始浓度/(mol•L-1) |
平衡浓度/(mol•L-1) |
| Ⅰ |
N2O4 |
0.100 |
0.040 |
| NO2 |
0 |
0.120 |
|
| Ⅱ |
N2O4 |
0 |
0.014 |
| NO2 |
0.100 |
0.072 |
下列说法正确的是
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B. 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C. 平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
| A.不变 | B.增大 |
| C.减小 | D.无法判断 |
反应:L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断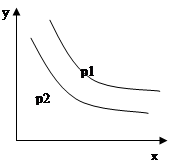
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.无法判断a,b大小
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3mol/L | B.Y2为0.4mol/L |
| C.X2为0.2mol/L | D.Z为0.4mol/L |
下列能用勒沙特列原理解释的是
| A.加入催化剂后H2 和O2反应生成水 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
某温度下在固定体积的密闭容器中发生如下反应:2M(g)+N(g)  2E(g),若开始时只充入2molE(g),达到平衡时,混合气体的压强比起时增大了20%;若开始时只充入2molM和1molN的混合气体,达到平衡时M的转化率为
2E(g),若开始时只充入2molE(g),达到平衡时,混合气体的压强比起时增大了20%;若开始时只充入2molM和1molN的混合气体,达到平衡时M的转化率为
| A.20% | B.40% | C.60% | D.80% |