在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。

在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1,
平衡时混合气体中NO2的体积分数为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),
②列式计算温度T时反应的平衡常数K 。
(3)温度T时反应达平衡后,向容器中,迅速充入含0.08mol的NO2和0.08mol N2O4的混合气体,此时速率关系v(正) v(逆)。(填“大于”,“等于”,或“小于”)
(6分)将两张圆形滤纸分别折叠成漏斗状,套在一起使四周都是四层,把内层纸漏斗取出,在底部剪一个孔,用水湿润,再与另一纸漏斗套在一起,架在铁架台的铁圈上,下面放有盛有细沙的蒸发皿,将5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在纸漏斗中,引发铝热反应。完成下列问题。
(1)上述反应的化学方程式为_______________,铝热反应可用于________(填写一种用途)。
(2)引发铝热反应的实验操作是________。
A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素,已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又如A、C两元素原子序数之和是B、D两元素原子序数之和的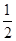 。 请回答下列问题
。 请回答下列问题
(1)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:________,其晶体中所含化学键的类型有________。
(2)A2B与A2D的沸点:A2B________A2D(填“高于”或“低于”),其原因是___________。
(3)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:___________。
(4)碳元素的一种同位素可测定文物年代,这种同位素的符号是______。H2O2的化合物类型是_______(填“共价化合物”或“离子化合物”)。
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。按照实验步骤依次回答下列问题: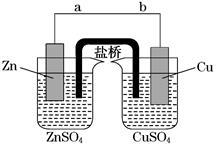
(1)导线中电子流向为____________(用a、b表示)。
(2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示) ;
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
(4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。
正极反应_____________;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。
②2C2H2+5O2 4CO2+2H2O:_____________。
4CO2+2H2O:_____________。
③6H2O+6CO2  C6H12O6(葡萄糖)+6O2:__________。
C6H12O6(葡萄糖)+6O2:__________。
I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III.已知乙烯能发生以下转化:
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
(2小题每空3分,1、3小题每空2分,共16分)已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛: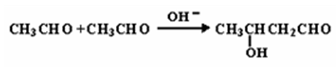
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的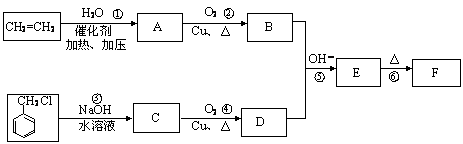
已知:反应⑥为含羟基的物质在浓硫酸催化作用下分子内脱水的反应。反应⑤为碱性条件下醛醛加成反应,请回答
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)写出下列转化的化学方程式:
②_________________。
③ 。
写出有关反应的类型:① ,④ 。
(3)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。