高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:
2Fe(OH)3 +3KClO+4KOH=2K2FeO4 + 3KCl + 5H2O ,下列说法正确的是
| A.反应中KClO做还原剂 |
| B.KCl是还原产物 |
| C.K2FeO4中铁的化合价为 +7 |
| D.制备K2FeO4时,1 molFe(OH)3得到3 mol电子 |
下列各组物质与其用途的关系不正确的是( )
| A.过氧化钠:供氧剂 | B.烧碱:治疗胃酸过多的一种药剂 |
| C.氧化铝:耐火材料 | D.明矾:净水剂 |
下列推断正确的是( )
| A.SiO2、CO2均是酸性氧化物,都能与NaOH溶液反应 |
| B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
下列装置所示的实验中,能达到实验目的的是( )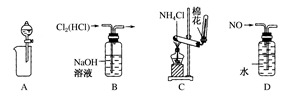
| A.从Mg(OH)2悬浊液中分离出Mg(OH)2 | B.除去Cl2中的HCl |
| C.实验室制氨气 | D.排水法收集NO |
类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论中正确的是( )
| A.SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 |
| B.盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 |
| C.SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 |
| D.常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 |
配制一定体积、一定物质的量浓度的溶液,对实验结果产生偏低影响的是( )
| A.容量瓶中原有少量蒸馏水 | B.溶液未冷却至室温就转移到容量瓶中定容 |
| C.定容时仰视观察液面 | D.定容时俯视观察液面 |