如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
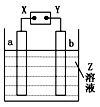
|   |
a极板 |
b极板 |
X电极 |
Z |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
 
下列说法错误的是
| A.1mol 氢 | B.1molO | C.1mol CO2 | D.1mol H2 |
已知:①CO(g)+H2O(g) CO2(g)+H2(g)ΔH1="-41.2" kJ/mol
CO2(g)+H2(g)ΔH1="-41.2" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g) ΔH2="+247.3" kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g)ΔH3
CO(g)+3H2(g)ΔH3
若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是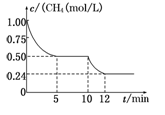
| A.ΔH3=+206.1 kJ/mol |
| B.反应③进行到10 min时,改变的外界条件可能是升高温度 |
| C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ |
| D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是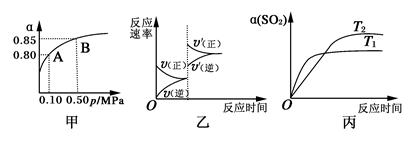
A.由图甲知 ,若密闭容器的体积为10L,则A点SO2的平衡浓度为0.4 mol·L-1 ,若密闭容器的体积为10L,则A点SO2的平衡浓度为0.4 mol·L-1 |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2︰1︰2 |
| C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
下列有关反应热的比较判断中,正确的个数是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1; CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2;
上述两反应中的ΔH1>ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH3; H2(g)+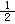 O2(g)=H2O(l) ΔH4;
O2(g)=H2O(l) ΔH4;
上述两反应中的ΔH3>ΔH4
③t℃时,在一定条件下(起始的体积和压强相同),将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
上述两反应中的Q1>Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH5; CaO(s)+H2O(l)=Ca(OH)2(s) ΔH6
上述两反应中的ΔH5>ΔH6
| A.1个 | B.2个 | C.3个 | D.4个 |
在强碱性的无色溶液中,可以大量共存的一组离子是:
| A.CrO42-、K+、Na+、SO42- | B.Fe3+、NO3-、HCO3-、Na+ |
| C.Na+、ClO-、AlO2-、NO3- | D.NH4+、NO3-、K+、SO42- |