下列说法中正确的是( )

| A.Na2S2O3+2HCl==2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
B.若在恒容容器中发生反应:N2+3H2 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 |
| C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示 |
D.若在恒压容器中发生反应:2SO3 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 |
向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-2.92kJ·mol—1 |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-0.72kJ·mol—1 |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-73kJ·mol—1 |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-18kJ·mol—1 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
下列措施或事实能用勒沙特列原理解释的是
| A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成 |
| B.钢铁在潮湿的空气中生锈 |
| C.H2、I2、HI平衡混合气加压后颜色变深 |
| D.新制的氯水在光照下颜色变浅 |
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO + H2O 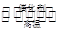 CO2+ H2 CO2+ H2 |
下图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是
| A.电源A上的a极是正极 |
| B.d极上的电极反应方程式为2Cl--2e-=Cl2↑ |
| C.e、f极上产生的气体体积比为2:1 |
| D.C中溶液的pH增大 |