(1)某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
(2)某温度下的水溶液中,c(H+) = 10x mol/L,c(OH—) = 10y mol/L,x和y的关系如图所示。计算:
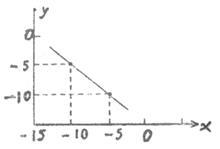
①该温度下水的离子积为_____
②该温度下,0.01mol/L的NaOH溶液的pH为_______
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应。
正极反应 ;
负极反应 。
某兴趣小组为了提高电池的效率,设计了下图所示的原电池。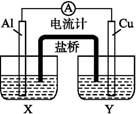
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应:
Al片( ) , Cu片( ) 。
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示: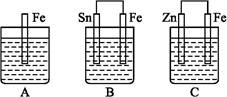
(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“升高”“降低”或“不变”)。
(3)C中被氧化的金属是 ,总反应式为 。
在容积不变的密闭容器中,分别充入1.0 mol N2和3.0 mol H2,在不同温度下,任其发生反应:N2(g)+3H2(g) 2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。
2NH3(g)。分别在同一时刻,不同温度下测定NH3的含量,然后绘制出如下图所示的曲线。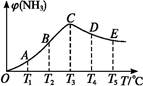
请回答下列问题:
(1)A、B、C、D、E五点中,尚未达到平衡状态的是 。
(2)此可逆反应的正反应是 (填“放热”或“吸热”)反应。
(3)AC段的曲线是增函数,CE段的曲线是减函数,试从反应速率和化学平衡的角度说明理由: 。
近年来,随着人们对化石能源大量的开发使用,不但使得煤、石油、天然气的储量大大减少,而且直接燃烧化石燃料造成的环境污染问题,也是人类面临的重大挑战,如何实现化石燃料的综合利用,提高效率,减少污染被提上了日程。为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:
2H2(g)+CO(g)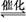 CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
| t/s |
0 |
500 |
1 000 |
| c(H2)/(mol·L-1) |
5.00 |
3.52 |
2.48 |
| c(CO)/(mol·L-1) |
2.50 |
(1)在500 s内用H2表示的化学反应速率是 。
(2)在1 000 s内用CO表示的化学反应速率是 ,1 000 s时CO的转化率是 。
(3)在500 s时生成的甲醇的浓度是 。