已知下列热化学方程式:
Zn(s)+1/2O2(g)===ZnO(s)ΔH1=-351.1 kJ/mol
Hg(l)+1/2O2(g)===HgO(s)ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l)ΔH3,其中ΔH3是
| A.-441.8 kJ/mol | B.-254.6 kJ/mol |
| C.-438.9 kJ/mol | D.-260.4 kJ/mol |
下列反应的离子方程式不正确的是
| A.等体积、等物质量浓度的Ca(H2PO4)2溶液与NaOH溶液混合:Ca2++H2PO4-+OH- ="=" CaHPO4↓+H2O |
| B.过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- |
| C.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:NH4++HSO3-+2OH-=SO32-+NH3↑+2H2O |
| D.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.100mL 1mol·L-1 FeCl3溶液中含阳离子数为0.1NA |
| B.标准状况下,2.24 L乙醛完全燃烧所得CO2分子数为0.2NA |
| C.0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA |
| D.80 mL 10 mol·L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
下列说法你认为不正确的是
A.实验室从苯酚中分离出苯的过程中,可选用右图装置及操作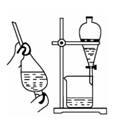 |
| B.化学反应中原子可重新组合、也可以破裂,爆炸过程中不一定伴随着化学反应 |
| C.大气中的氮气可通过生物固氮、自然固氮和工业固氮等方式从游离态转变为化合态,氮的固定过程中必定发生氧化还原反应 |
| D.化学家合成和分离了超过4500万种物质基础。化学合成和分离技术为信息技术、生物技术、航空航天技术等奠定了物质基础 |
有可逆反应mA(s) + nB(g) pC(g) + qD(g),反应过程中,当其它条件不变时,C的物质的量与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是
pC(g) + qD(g),反应过程中,当其它条件不变时,C的物质的量与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是
| A.到达平衡后,若使用催化剂,C的物质的量增大 |
| B.平衡后,若升高温度,平衡则向逆反应方向移动 |
| C.平衡后增大A的量,有利于提高A的转化率 |
| D.化学方程式中一定是n>p+q |
25 ℃时,水的电离达到平衡:H2O H++OH-;DH>0,下列叙述正确的是
H++OH-;DH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.将水加热,KW增大,pH不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |