根据下列操作及现象,判断所得结论正确的是( )
| 序号 |
操作及现象 |
结论 |
| A |
将0.1 mol·L-1氨水稀释成0.01 mol·L-1,测得pH由11.1变成 10.6 |
稀释后NH3·H2O的电离程度减小 |
| B |
常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 |
常温下水解程度: CO32- >HCO3 - |
| C |
向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 |
温度升高,Fe3+的水解程度增大 |
| D |
溴乙烷与NaOH乙醇溶液共热产生的气体直接通入KMnO4酸性溶液中,溶液褪色 |
产生的气体为乙烯 |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是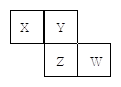
| A.原子半径:W> Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.4种元素的单质中,Z单质的熔、沸点最低 |
| D.W单质能与水反应,生成一种具有漂白性的物质 |
在一个体积不变的密闭容器中发生可逆反应:A2(g)+B2(g) 2AB(g),达到平衡的标志是
2AB(g),达到平衡的标志是
A.容器的总压强不随时间而变化
B.容器内气体的密度不再改变
C.单位时间内有nmolA2生成的同时有nmolB2消耗
D. v正(A2)= 2v逆(AB)
反应4A(g)+5B(g)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L· s) B.v(A)= 0.030mol/(L ·s)
C.v(C)=0.040mol/(L· s) D.v(D)=0.060mol/(L· s)
下列说法正确的是
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
| A.①③⑥ | B.②④⑥ | C.②③④ | D.①③⑤ |
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是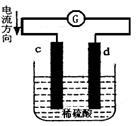
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |