某化学研究性学习小组对电解质溶液作出如下的归纳总结(均在常温下),其中正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa、b.C6H5ONa、c.NaHCO3、d.NaOH。其溶液物质的量浓度由小到大的顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
| A.③④⑥ | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
下列含有非极性键的共价化合物是(C )
| A.HCl | B.Na2O2 | C.CH3CH3(乙烷) | D.CH4 |
在下图所表示的微粒中,氧化性最强的是(B )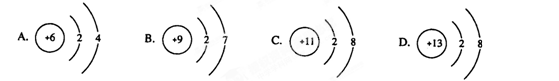
下列说法不正确的是(A)
A.酸性强弱:HIO4>HBrO4>HClO4 B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱:Na>Mg>Al
居里夫人因发现了镭元素获得1911年诺贝尔化学奖,距今百年,这也是居里夫人第二次获得诺贝尔奖,广为世人称道。下列关于镭的性质的描述中不正确的是(B )
| A.在化合物中呈+2价 | B.氢氧化物呈两性 |
| C.单质与水反应,放出氢气 | D.碳酸盐难溶于水 |
法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是(C )
| A.该粒子不显电性 | B.该粒子质量数为4 |
| C.在周期表中与氢元素占同一位置 | D.该粒子质量比氢原子大 |