下列有关实验原理或实验操作正确的是
| A.氯乙烷水解后的碱性溶液不能用硝酸酸化,因为硝酸会把Cl-氧化,再加入AgNO3溶液就不会产生白色沉淀 |
| B.实验室用图1所示装置制取乙烯并验证其某些性质 |
| C.利用图2装置除去甲烷中的乙烯以达到提纯目的 |
| D.0.5g淀粉、5mL20%H2SO4和5mL蒸馏水混合,加热5min后冷却,然后向其中加入新制银氨溶液,水浴加热,无银镜产生,说明淀粉没有水解 |
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是
| 物质及其杂质 |
检验 |
除杂 |
|
| A |
Cl2(HCl) |
湿润的淀粉KI试纸 |
饱和食盐水 |
| B |
NO(NO2) |
观察颜色或湿润的淀粉KI试纸 |
水 |
| C |
CO2(HCl) |
AgNO3溶液(含稀硝酸) |
饱和Na2CO3溶液 |
| D |
NaHCO3溶液(Na2CO3) |
Ca(OH)2溶液 |
过量CO2 |
下列说法正确的是
| A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
| B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 |
| C.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- |
| D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
以下有关物质的量浓度的叙述正确的是
| A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 |
| B.150 mL 1mol·L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol·L-1的氯化铝溶液中的c(Cl-)相等 |
| C.20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0 mol·L-1,则此溶液中KCl 的质量分数为25.38% |
| D.20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2% |
下列各组物质发生化学反应时,由于反应物的量不同而生成不同产物的是
①CO2与NaOH溶液 ②NaHCO3溶液与盐酸 ③Na与氧气
④C与O2 ⑤AlCl3溶液与氨水 ⑥Na2S与FeCl3溶液
| A.除③外 | B.除①④⑥外 | C.除②③⑤外 | D.除②⑤外 |
下列物质转化在给定条件下能实现的是
①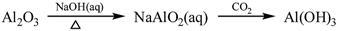
②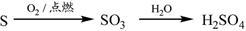
③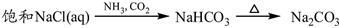
④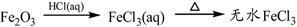
⑤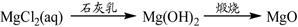
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |