数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。
已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是 。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是 ;该气化气可在适当温度和催化剂下合成液体燃料甲醇,该反应方程式为 。
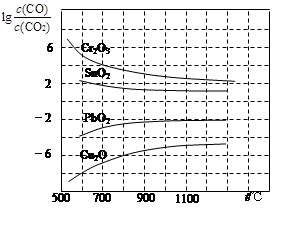
(3)CO常用于工业冶炼金属,右下图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。
下列说法正确的是 。
| A.工业上可以通过增高反应装置来延长矿 石和CO接触的时间,减少尾气中CO的含量 |
| B.CO不适宜用于工业冶炼金属铬(Cr) |
| C.工业冶炼金属铜(Cu)时较低的温度有 利于提高CO的利用率 |
| D.CO还原PbO2的反应ΔH>0 |
(4)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,则其阳极的电极反应式为 。
2CO+O2,则其阳极的电极反应式为 。
(5)将CO通入银氨溶液中可析出黑色的金属颗粒,写出反应方程式 。
用化学用语表达下列变化过程,其中(1)~(3)写化学方程式,(4)~(5)写离子方程式。
(1)金属钠与水反应______________________
(2)工业合成氨____________________________
(3)二氧化硫与硫化氢反应___________________________
(4)碳酸氢钠溶液与稀盐酸反应_______________________
(5)少量氯气通入碘化钾溶液中_______________________
掺杂微量铜、硼、镓、硒等元素的单晶硅太阳能电池是第三代太阳能电池之一。
(1)Cu2+的电子排布式为___________________。
(2)已知铜转化为水合离子过程如下:
已知I1=745.5kJ/mol,I2=1957.3kJ/mol。在水溶液中Cu2+比Cu更稳定的原因是_____________。
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2。1mol(SCN)2含有π键的数目为_______________。HSCN有两种结构,H-S-C≡N(硫氰酸)的沸点低于H-N=C=S(异硫氰酸)的沸点,其原因是_________________。
(4)BF3能与NH3反应生成配合物BF3-NH3,该配合物中B原子的杂化方式为___________________。
(5)铜和硒可形成的半导体团簇分子的球棍模型如图所示,其分子式为__________________。
(6)镓与某有机物形成的配合物过程如下图,在图上画出产物中的配位键。
(7)与Si同周期部分元素的电离能如下图所示,其中a、b和c分别代表_____________。
| A.a为I1、b为I2、c为I3 | B.a为I2、b为I3、c为I1 |
| C.a为I3、b为I2、c为I1 | D.a为I1、b为I3、c为I2 |
Ⅰ.由苯乙烯制得的聚苯乙烯可用于制造一次性餐具。
(1)苯乙烯的分子式为_______________。
(2)苯乙烯制取聚苯乙烯的化学方程式为______________________。
Ⅱ.聚苯乙烯塑料性质稳定,会造成严重的“白色污染”。为此人们开发出一种聚乳酸塑料来替代聚苯乙烯。聚乳酸合成过程如下:
(3)淀粉和纤维素的分子式均可表示为(C6H10O5)n,下列关于淀粉和纤维素的说法正确的是( )
| A.互为同分异构体 | B.水解最终产物相同 |
| C.纤维素是纯净物 | D.均是高分子化合物 |
(4)乳酸分子中所含官能团有_________________(填名称)。
(5)根据结构推断聚乳酸可能发生的反应类型是______________,并据此说明用聚乳酸塑料替代聚苯乙烯塑料的好处是_____________。
(6)乳酸与足量Na反应的化学方程式为____________________。
氮元素可形成丰富多彩的物质。
(1)基态氮原子的价电子轨道表示式为______________;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为___________________。
(2)光化学烟雾易在PM2.5尘粒的催化作用下形成,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。下列说法正确的是__________________。
| A.N2O与CO2互为等电子体,其结构式为N=N=O |
| B.O3的沸点大于O2 |
| C.CH2=CHCHO分子中碳原子的杂化方式为sp2、sp3 |
| D.HCOOH在水中溶解度大的原因与氢键有关 |
(3)在配合物中,下列微粒NH3、NH4+、NH2OH不能作为配位体的有____________。
(4)图a为六方氮化硼晶体结构示意图,该晶体中存在的作用力有______________。

(5)六方氮化硼在高温高压下可转化为立方氮化硼,其晶胞结构如图b,晶胞边长为dcm,该晶胞中含有_________个氮原子、__________个硼原子,立方氮化硼的密度是__________g·cm-3(阿伏伽德罗常数的值为NA)
海水提镁的工业流程如下
(1)煅烧贝壳时,贝壳的主要成分发生了什么变化?__________(用化学方程式表示)。
(2)从海水中的镁离子到金属镁,主要经历了三步化学变化,写出前两步反应的化学反应方程式:
①______________;②_______________。
③第三步反应(MgCl2 Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
Mg+Cl2↑)中,每生成1molMg,转移的电子的数量是____________。
(3)在生产过程中采用了一些措施提高经济效益,请写出一点____________________。
(4)输送氯气的管道需要定期检查是否漏气,管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=N2+6HCl。下列说法中正确的是__________。
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应中的HCl是氧化产物,N2是还原产物