现有X、Y、Z、M四种元素均为短周期元素。有关信息如下表:
| |
原子或分子结构、单质或化合物相关信息 |
| X |
含X元素的物质焰颜色反应为黄色 |
| Y |
单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
| Z |
Z元素原子易失去2个电子形成8电子结构的离子 |
| M |
M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
(1)X元素在周期表的位置是 ;
(2)1个Y单质分子中含 对个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为 。
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2,其溶液显黄色.则X2M2的电子式为 ,用化学方程式表示X2M溶液在空气中的变质过程 .
下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
(1)该反应的反应物是______。
(2)该反应的化学方程式为__________。
(3)达到平衡状态的所需时间是2min,A物质的平均反应速率为_______。
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空: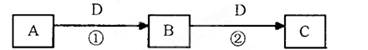
(1)若A可用于自来水消毒,D是生产、生活中用量大、用途广的金属单质,写出C转化为B的化学方程式为;用A制漂白粉的反应方程式为。
(2)若D与C60互为同素异形体,A与O3互为同素异形体,则C在高炉炼铁中的主要反应方程式为。
(3)若D是空气质量预报要报的气体,相同条件下密度是氧气的两倍,A是烧碱溶液,则可以验证B是否变质的一组试剂是(请写出试剂名称)。若已部分变质则实验现象为。
(4)若A、B、C均为两种元素组成的非电解质且常温下均为气态,则反应①的化学方程式为。
Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为(保留两位小数)。若提高温度到800℃进行,达平衡时,K值(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
| A.高温高压 |
| B.加入催化剂 |
| C.减少CO2的浓度 |
| D.增加CO的浓度E.分离出二甲醚 |
(5)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是;
(2)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1H2SO4/ mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:V2 V5 =, V6=,V8=;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
| 组别 |
c(HA)/mo1·L-1 |
c(NaOH)/mo1·L-1 |
混合液pH |
| 甲 |
c |
0.2 |
pH = 7 |
| 乙 |
0.2 |
0.1 |
pH>7 |
| 丙 |
0.1 |
0.1 |
pH = 9 |
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ?(选填“是”或“否”)。
(5)分析乙组实验数据,HA是酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是。
(6)丙组所得混合液中由水电离出的c(OH-) =mo1·L-1。
Ⅰ.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:;
下列哪个装置示意图可防止铁棒被腐蚀。
Ⅱ.某小组为研究电化学原理,设计如下图装置。请回答下列问题:
(1)a和b不连接时,铁片上发生反应的离子方程式为,此时能量转化形式主要是化学能转化为能。
(2)a和b用导线连接时,外电路中的电子是从电极流出(填“Fe”或“Cu”),(填Cu2+ 或SO42-)离子朝负极移动,Cu极所发生反应的电极反应式为。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的(填“正极”或“负极”)连接;此时 铜片上发生的电极反应式为。
铜片上发生的电极反应式为。