Ⅰ.在用稀硫酸与锌制取氢气的实验中,加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)加入少量硫酸铜溶液可以加快氢气生成速率的原因是 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,某学习小组设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1H2SO4 / mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液 / mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O / mL |
V7 |
V8 |
V9 |
15 |
10 |
0 |
请完成此实验设计,其中:V2 V5 = , V6= ,V8= ;
(第一空填“>”、“<”或“=”;后三空填具体数值)
Ⅱ.常温下,某一元酸HA和NaOH溶液等体积混合,HA和NaOH的浓度以及混合后溶液的pH如下表:
| 组别 |
c(HA)/mo1·L-1 |
c(NaOH)/mo1·L-1 |
混合液pH |
| 甲 |
c |
0.2 |
pH = 7 |
| 乙 |
0.2 |
0.1 |
pH>7 |
| 丙 |
0.1 |
0.1 |
pH = 9 |
请回答下列问题:
(4)仅从甲组情况分析,c是否一定等于0.2 ? (选填“是”或“否”)。
(5)分析乙组实验数据,HA是 酸(选填“强”或“弱”)。该混合液中离子浓度由大到小的顺序是 。
(6)丙组所得混合液中由水电离出的c(OH-) = mo1·L-1。
合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是 (填字母序号,下同)。
A.青花瓷瓶 B.橡胶充气艇C.不锈钢锅
(2)生铁是常用的合金,生铁属于 (填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明 。
(4)黄铜渣中约含 、
、 、
、 、
、 ,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):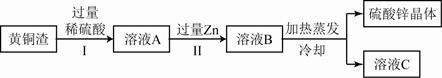
已知: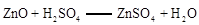 ;
;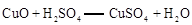
①II中反应的化学方程式为 ;
②下列说法正确的是 。
a.I、II中的操作均包含过滤 b.溶液A中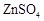 的质量大于
的质量大于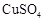
c.溶液A 的质量小于溶液Bd.溶液C中溶质的质量分数小于溶液B
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ΔH>0。
CH3COO‾+H+ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=__________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)______V(醋酸),反应的最初速率为:υ(盐酸)_____υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb;溶液中各离子的浓度按照由大到小排序为___________。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)。
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=____________。
(3)该反应的逆反应速率与时间的关系如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时_________________________;
t8时_________________________。
②t2时平衡向__________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)上述反应在第5 s时,NO的转化率为 。
(2)如图中表示NO2变化曲线的是 。用O2表示0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)="2v" (O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 = 2PbSO4 ↓ + 2H2O,据此判断工作时正极反应为______________。
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量无污染物质并放出大量热。反应的化学方程式为 。
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极发生的电极反应为 ;
(3)X电极上发生的电极反应为 ;