Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
| A.高温高压 |
| B.加入催化剂 |
| C.减少CO2的浓度 |
| D.增加CO的浓度E.分离出二甲醚 |
(5)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
实验室需要配制2.0mol·L-1的NaCl溶液500 ml。
(1)本实验所必需的仪器有托盘天平(精确到0.1g)、药匙、烧杯、量筒、玻璃棒、胶头滴管、
以及等质量的两片滤纸。
(2)某学生在摇匀后发现液面低于刻度线再加水,会导致结果(填“偏高”、“偏低”、“无影响”)。
洪灾过后,饮用水的杀菌消毒成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为;
(2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)△ MnCl2+Cl2+ 2H2O,其中,氧化产物是(填化学式),氧化剂与还原剂的物质的量之比为,生成的Cl2在标准状况下的体积为672 ml ,则转移电子mol。
(3)检验Cl2已集满的方法:。
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
Ⅰ.一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应2HI H2+I2,H2物质的量随时间的变化如图所示。0~2 min内 的平均反应速率v(HI)=_________。该温度下,H2(g)+I2(g)
H2+I2,H2物质的量随时间的变化如图所示。0~2 min内 的平均反应速率v(HI)=_________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=_____。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_____是原来的2倍。
2HI(g)的平衡常数K=_____。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_____是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
Ⅱ.常温下,将pH=3的盐酸a L分别与下列三种溶液混合,
结果溶液均呈中性。
①浓度为1.0 ×l0-3 mol.L-1的氨水b L;
②c(OH-)=1.0×10-3mol.L-l的氨水c L;
③c(OH-)=1.0×10-3 mol ·L-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是:。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。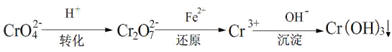
(1)转化过程中存在平衡2CrO42- + 2H+ Cr2O72- + H2O能说明反应到达平衡状态的是。
Cr2O72- + H2O能说明反应到达平衡状态的是。
| A.CrO42-和Cr2O72-的浓度相同 | B.2ν(Cr2O72-)=ν(CrO42-) |
| C.溶液的pH值保持不变 | D.溶液颜色保持不变 |
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO42-有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。
①转化后所得溶液中c(Cr2O72-)=。
②已知:常温下该反应的平衡常数K=1014,上述转化后所得溶液的pH为。
(3)若常温下Ksp(Cr(OH)3) =10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。
金属元素及其化合物在科学研究和生产生活中有着广泛的用途。
(1)氢气还原氧化铜时,产生的红色物质,冷却后加入稀硫酸发现溶液呈淡蓝色,写出该现象发生的离子方程式 。
(2)铝的某种超原子结构(Al13)具有40个价电子时最稳定。请预测稳定的Al13所带的电荷数为。取铝合金(含铝90%)1.5 g与80 mL 3mol•L-1 盐酸充分反应(合金中其它成分不参加反应)。滤去不溶物,将滤液稀释到100mL,取出稀释液5mL,加入0.6 mol•L-1 的氨水使Al3+ 恰好完全沉淀。上述铝合金和盐酸反应的过程中生成氢气_________L(标准状况)。使Al3+ 恰好完全沉淀时,消耗氨水_________mL。
甲烷的电子式是,结构式是,其空间构型是,在光照的条件下,甲烷可以和氯气发生反应。甲烷在空气中完全燃烧的化学方程式。