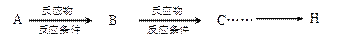以化合物A为原料合成化合物M的线路如下图所示。
已知: ;
;
(1)①的反应类型为______;④的反应类型为______。
(2)化合物A不可能具有的化学性质是____________。
a.氧化反应 b.还原反应 c.消去反应 d.取代反应 e.加成反应
(3)⑤为取代反应,除生成M外,还有CH3OH生成,则物质Y的结构简式为_______。
(4)写出同时满足下列条件的B的两种同分异构的结构简式:________和_________
a.含有醛基,且能与FeCl3溶液发生显色反应
b.分子中有4种不同化学环境的氢
(5)反应②和③的顺序_____(填“能”或“不能”)交换,理由是______________。
实验室用共沉淀法制备纳米级Fe3O4的流程如下:
该方法的关键为促进晶粒形成,并控制晶体生长。试回答下列问题:
(1)该反应原理的离子方程式可表示为 ▲。
(2)反应温度需控制在50℃,其方法是 ▲,温度偏低造成产量低的可能是 ▲。
(3)在搅拌Ⅱ的过程中还需加入10 mL正丙醇,其作用是 ▲。
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是 ▲。
(5)由上述分析可知,影响纳米级Fe3O4粒径大小的因素有(写出一条) ▲。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。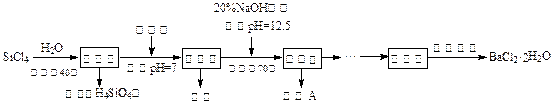
(1)SiCl4水解控制在40℃以下的原因是 ▲。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)="Si(s)+3HCl(g)" ΔH2=189 kJ/mol
则由SiCl4制备硅的热化学方程式为 ▲。
(2)加钡矿粉时生成BaCl2的离子反应方程式是 ▲。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是 ▲,控制温度70℃的目的是 ▲。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到·2H2O。实验室中蒸发浓缩用到的含硅酸盐的仪器有 ▲种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是 ▲。
A.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如S02、SnCl2等还原制得: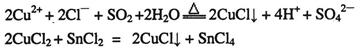
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子: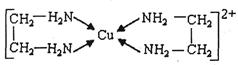
请回答下列问题:
(1)基态Cu原子的核外电子排布式为______________。H、N、O三种元素的电负性由大到小的顺序是_____。
(2)SO2分子的空间构型为____。与SnCl4互为等电子体的一种离子的化学式为______
(3)乙二胺分子中氮原子轨道的杂化类型为_______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______________________。
(4)②中所形成的配离子中含有的化学键类型有__________。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_________。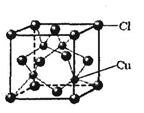
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①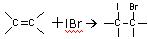 ②IBr+KI=I2+KBr③I2+2S2O32-=2I-+S4O62-
②IBr+KI=I2+KBr③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用,用方程式表示碘瓶必须干燥的原因。
(2)步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是。
(3)步骤Ⅲ中所加指示剂为,滴定终点的现象。
(4)反应结束后从液体混合物中回收四氯化碳,则所需操作有。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)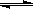 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。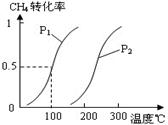
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1P2(填“<”、“>”或“=”),100℃时平衡常数为。
③在其它条件不变的情况下降低温度,逆反应速率将(填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) 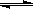 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H0,△S0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
n (CO)/n(H2) |
P(MPa) |
| ⅰ |
150 |
1/3 |
0.1 |
| ⅱ |
5 |
||
| ⅲ |
350 |
5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。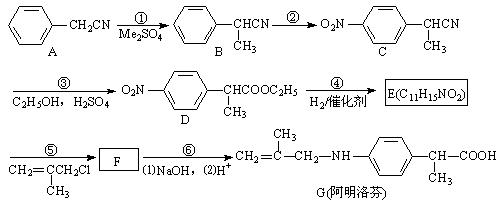
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示。
(2)E中的官能团有:(写名称)。
(3)写出F的结构简式。
(4)反应③可以看成是两步反应的总反应,第一步是氰基(—CN)的完全水解反应生成羧基(—COOH),请写出第二步反应的化学方程式。
(5)化合物 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物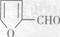 合成
合成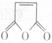 。提示:①合成过程中无机试剂任选;②
。提示:①合成过程中无机试剂任选;②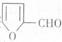 在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下:
在400摄氏度金属氧化物条件下能发生脱羰基反应;③合成反应流程图表示方法示例如下: