能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式______,它位于周期表______区。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为_______;1 mol C60分子中σ键的数目为_____个。

(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
①第一电离能:As____Ga(填“>”、“<”或“=”)。
②SeO2分子的空间构型为________。
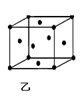
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4 NH3 Cu NF3+3 NH4F,该反应中NH3的沸点 (填“>”、“<”或“=”)HF的沸点,NH4F固体属于 晶体。往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________ _______ 。图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
27.氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g)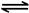 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号)。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号)。
a.选择适当的催化剂b.增大压强
c.及时分离生成的NH3d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)=mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)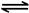 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)。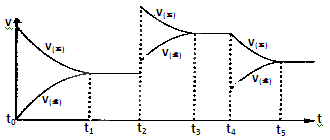
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:。
(5)已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是.从理论上分析,该电池工作过程中(填“需要”或“不需要”)补充碱(KOH).
26.铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因。
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式________________________。
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3 □CuSO4 +□ Cu(NO3)2+□NO↑+ □
□CuSO4 +□ Cu(NO3)2+□NO↑+ □
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为(填化学式)。
18.(共6分)现有下列浓度均为0.1 mol/L的电解质溶液:
① Na2CO3、② NaHCO3、③ 、④ CH3COONH4、⑤ NH4HCO3
、④ CH3COONH4、⑤ NH4HCO3
(1)上述5种物质的溶液既能与盐酸又能与烧碱溶液反应的是(填写序号)。
(2)已知溶液④呈中性,该溶液中离子浓度由大到小的顺序是。
(3)已知溶液⑤呈碱性,比较④、⑤两溶液的酸碱性,可以得出的结论是。
17.(共6分)金属Na、Mg、Al有广泛的应用。
(1)周期表中Na、Mg、Al所在周期是。
(2)为比较Na、Mg、Al的金属性,进行了如下实验:
实验1:各取1.0 g金属钠和镁,分别加入到5 mL水中,钠与水反应剧烈,镁与水反应缓慢。
实验2:各取1.0 g的镁条和铝条,分别加入到5 mL 1.0 mol/L盐酸中,镁与盐酸反应剧烈,铝与盐酸反应较剧烈。
已知:元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度来判断。
由实验1和实验2得出的结论是,用原子结构理论解释:同周期元素从左到右,。
(3)Na、Mg、Al都可以用于制备储氢的金属氢化物。
① NaH是离子化合物,能与水发生氧化还原反应生成H2,该反应的还原剂是。
② NaAlH4是一种良好的储氢材料。NaAlH4与水反应的化学方程式是。
21.在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如下图: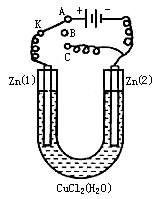
(1)如果把电键K接A,这一装置形成电解池装置,____是阳极,其电极反应式是_________________;
(2)上述反应进行5min后,转换电键K到C,这一装置形成原电池装置,________极是负极,该装置发生反应的总化学方程式是______________
(3)上述装置进行2min后,再转换电键K到B,在极上发生的腐蚀属于腐蚀。