下列说法正确的是( )
| A.若2H2(g)+O2(g) = 2H2O(g) ΔH ="-483.6" kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1 |
| B.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
| C.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| D.由BaSO4(s) + 4C(s) =" 4CO(g)" + BaS(s) △H1 = +571.2kJ•mol-1 ① |
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2 = +226.2kJ•mol-1 ②
可得反应C(s) + CO2(g) =" 2CO(g)" 的△H = +172.5kJ•mol-1
在通常条件下,下列各组物质的性质排列正确的是( )

A.熔点: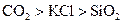 |
|
B.水溶性: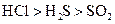  |
C.沸点:乙烷>戊烷>丁烷 |
D.热稳定性: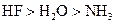 |
下列叙述中不正确的是 ( )
| A.天然蛋白质水解的最终产物是多种α-氨基酸 |
| B.所有蛋白质遇到硝酸后加热都会变黄 |
| C.蛋白质盐析是可逆的物理过程,利用该性质可提纯和分离蛋白质 |
| D.肥皂液、淀粉液、蛋白质溶液都可以产生丁达尔现象 |
从海水中可获得的在常温下为液体的单质是( )
| A.Mg | B.K | C.Br2 | D.I2 |
下列措施不能达到节能减排目的的是( )
| A.利用太阳能制氢燃料 |
| B.用家用汽车代替公交车 |
| C.利用潮汐能发电 |
| D.用节能灯代替白炽灯 |
有标态下的氢气和氧气的混合气体共13 g,体积为11.2 L,则氢气与氧气的体积比为,若用此混合气体冲入气球中,该气球能否飞上天?(填写“能”、“不能”或“无法确定”)