发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:2NH3(g) N2 (g) + 3H2(g) ΔH =+92.4 kJ·mol-1
N2 (g) + 3H2(g) ΔH =+92.4 kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是 。
(2) 已知:2H2 (g) + O2 (g) = 2H2O(g) ΔH =" -" 483.6 kJ·mol-1
NH3(l)  NH3 (g) ΔH =" 23.4" kJ·mol-1
NH3 (g) ΔH =" 23.4" kJ·mol-1
则,反应4NH3(l) + 3O2 (g) = 2N2 (g) + 6H2O(g) 的ΔH = 。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
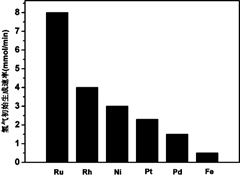
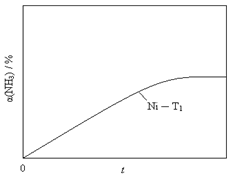
图1 图2
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K = 。
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
(16分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z的气态氢化物能与其最高价氧化物的水化物反应,G是地壳中含量最高的金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号)。
(2)Z在元素周期表中的位置为。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸d.NaOH溶液e.Na2CO3固体
(5)已知化合物C含有下述元素中的某一种元素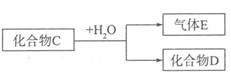
①若D是一种强酸,则C与水反应的化学方程式为。
有人认为“浓H2SO4可以干燥气体C”,某同学为了验证该观点是否正确,用如图装置进行实验.分液漏斗中应加入,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是。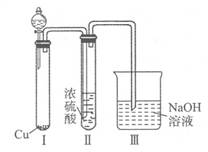
②若D是一种常见的强碱,则C与水反应的离子方程式为 。
(13分)雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某兴趣小组收集了该地区的雾霾,试样溶液经必要的预处理后,设计并完成了如下的实验: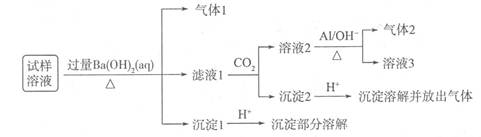
已知:NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,根据以上的实验操作与现象,回答下列问题:
(1)气体l的成分可能是,进一步确定该气体成分的方法是,
实验室制备该气体的方程式为。
(2)写出沉淀2产生气体的离子方程式。
(3)经过以上实验可知,该地区雾霾中一定存在的离子有。
(4)某同学采用了另外一种实验方法,取少量的试样直接加入硝酸银溶液产生白色沉淀,该同学由此就确定一定含有Cl-,你认为他的说法是否合理(填是或否),其理由是。
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,有红色金属析出且溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为。
PCT是一种新型聚酯材料,下图是某研究小组合成PCT的路线。
请回答下列问题:
⑴ 由A生成D的化学方程式为;
⑵ 由B生成C的反应类型是________________;
⑶ 由E生成F的化学方程式为,反应类型;
⑷ 写出D符合下列条件的所有同分异构体的结构简式:属于芳香族化合物且取代基只有一个,;
⑸B的同分异构体中,能发生水解反应,且苯环上一氯代产物只有一种的是(写结构简式)。
A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图,E元素在周期表中的位置是。
(2)A与C形成原子个数比为1:1的化合物甲,其中含有化学键类型为 。
(3)D与C按原子个数比为1:1形成化合物的电子式是 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是(填具体的化学式)。
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与 C形成的化合物甲反应的离子方程式。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式:;放电时溶液中H+移向(填“正”或“负”)极。
(7) E(s)+O2(g)EO2(g)△H1 E(g)+O2(g)EO2(g)△H2,
则△Hl△H2(填“>”或“<”或“=”)。