在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Al3+Mg2+Ba2+ Fe3+ |
| 阴离子 |
NO3-CO32-SiO32-SO42- OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
| |
阴离子 |
浓度c/(mol·L-1) |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________。
回答下列问题:
(1) 常温下,pH=5的盐酸和pH=9的氢氧化钠溶液按体积比9∶11混合,混合后溶液的pH为
(2)NH4Cl溶液显酸性,试用离子方程式 表示这一反应_____________________。
表示这一反应_____________________。
(3)已知水的电离方程式可写为2H2O 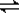 H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式________________________;在液氨中加入NH4Cl,则平衡将向________移动(填“正反应方向”或“逆反应方向”)。
H3O++OH-,液氨类似于水的电离,试写出液氨的电离方程式________________________;在液氨中加入NH4Cl,则平衡将向________移动(填“正反应方向”或“逆反应方向”)。
(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(选填“>”、“<”或“=”);若改用pH相同的盐酸和硫酸溶液,进行上述操作,则m________n(选填“>”、“<”或“=”)。
(18分)如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。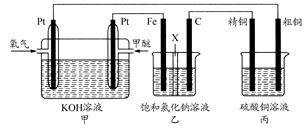
根据要求回答相关问题:
(1)通入氧气的电极为________(填“正极”或“负极”),写出负极的电极反应式___________________
 _____________________________________。
_____________________________________。
(2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________________________________________________________________。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在________(填“铁极”或 “石墨极”)区
“石墨极”)区
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成 的气体的分子数为________;丙装置中阴极析出铜的质量为_______
的气体的分子数为________;丙装置中阴极析出铜的质量为_______ _。
_。
(15分)某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为________(填字母)。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是_____________________________________________________________________。
②在配制硫酸亚铁溶液时,需加入铁粉的理由是 __________________________________________________
__________________________________________________ ______________________。
______________________。
Ⅱ.标定FeSO4溶液的浓度
( 1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为________,据此可测得FeSO4溶液的物质的量浓度为________mol·L-1。
1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为________,据此可测得FeSO4溶液的物质的量浓度为________mol·L-1。
(2)滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂,填字母)为指示剂,理由是____________________________________________________________________。
(10分)温室效应和资源短缺 等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
等问题和如何降低大气中的CO2含量并加以开发利用引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)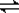 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。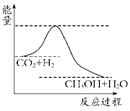
(1)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0
B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
(2)该反应平衡常数K的表达式为________________________________。
(3)温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)________mol·L-1·min-1。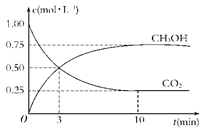
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有________。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
E.充入He(g),使体系总压强增大
工业上采用的一种污水处理方法如下:保持污水的pH在5.0 ~ 6.0之间,通过电解生成Fe(OH)3。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的 作用。某科研小组用该原理处理污水,设计装置示意图如所示。
作用。某科研小组用该原理处理污水,设计装置示意图如所示。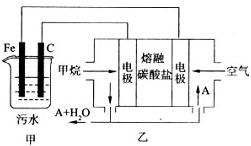
(l)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时应向污水中加入适量的。
a.HCl b.CH3CH2OH c.Na2SO4d.NaOH
(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是I.;II.。
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为
氧化剂,稀土金属材料做电极。正极的电极反应是;
(4)已知燃料电池中有1.6 g CH4参加反应,则C电极理论上生成
气体L(标准状况).
(5)若将装置中的甲部分换为如图所示的装置,电解 足量CuSO4,
足量CuSO4,
电解后加入可能恢复至原浓度。