下列说法中不正确的是
| A.对于任何化学反应来说,反应速率越大,反应现象就越明显 |
| B.在其他条件不变时,升高温度一定会加快化学反应的反应速率 |
| C.使用合理的催化剂,可以改变化学反应速率,但不能改变化学平衡状态 |
| D.增大反应物浓度,可使单位体积内活化分子数增加,反应速率加快 |
下列各项中表达正确的是
| A.CO2的结构式:O—C—O |
B.乙烯分子球棍模型: |
C.NaCl的电子式: |
D.F-的结构示意图: |
CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去(已知Ksp Fe(OH)3=4.0×10-38,Ksp Cr(OH)3=6.0×10-31)。已知电解后的溶液中c(Fe3+)为4×10-14 mol·L-1,此时溶液的pH(室温下测得)和溶液中c(Cr3+)分别为
| A. 6; 6×10-7 mol·L-1 | B. 7; 1×10-5 mol·L-1 |
| C.7 ; 4×10-8 mol·L-1 | D. 6; 1× 10-5 mol·L-1 |
现在所见的燃料电池主要有如下的四种,下面是这四种燃料电池的工作原理示意图,其中正极的反应产物为水的是
常温下,用0.1000 mol/L NaOH溶液分 别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。若以HA表示酸,下列说法正确的是
别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。若以HA表示酸,下列说法正确的是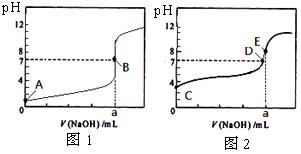
A.滴定醋酸的曲线是图1
B.达到B、E状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C.达到B、D状态时,反应消耗的n(CH3COOH)<n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)> c(H+) > c(OH—)
室温下,下列叙述正确的是(溶液体积变化忽略不计)
| ① |
② |
③ |
④ |
|||||
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
||||
| pH |
11 |
11 |
3 |
3
|