室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是()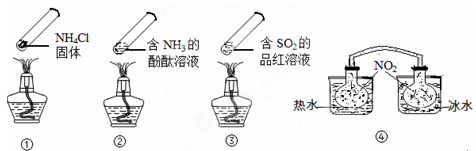
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 (已知:2NO2 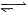 N2O4△H<0) N2O4△H<0) |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |
下列离子方程式表示正确的是()
| A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42—+Ba2++OH—==BaSO4↓+H2O |
| B.FeCl2溶液中滴加NaClO溶液生成红褐色沉淀:2Fe2+ + ClO- + 5H2O= 2Fe(OH)3↓+Cl-+ 4H+ |
| C.甲酸溶液滴到大理石台板上有气泡产生:2H+ + CaCO3 = CO2↑+ Ca2+ + H2O |
| D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3- + Ba2+ + OH- = BaCO3↓+ H2O |
已知某反应aA(g) +bB(g)  cC(g) +Q 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是()
cC(g) +Q 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是()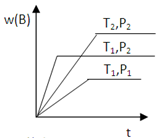
A.T1<T2, P1<P2,a+b>c ,Q>0B.T1>T2,P1<P2,a+b<c ,Q<0
C.T1<T2,P1>P2,a+b<c, Q>0 D. T1<T2,P1>P2,a+b>c ,Q<0
下列有关金属及其化合物的说法中,正确的是()
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②纯铁比生铁抗腐蚀性更强
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素
⑦往FeCl3溶液中滴入KI—淀粉溶液,溶液变蓝色
⑧铝粉和氧化镁粉末混合,高温能发生铝热反应
| A.4句 | B.5句 | C.6句 | D.7句 |
下列说法不正确的是( )
| A.自发反应在恰当条件下才能实现 |
| B.所有的化学反应都有能量变化 |
| C.升高温度,活化分子百分数增大,化学反应速率一定增大 |
| D.使用催化剂可以降低反应的活化能,增大化学反应速率,从而提高反应物的转化率 |