50mL 0.50mol•L﹣1盐酸与50mL 0.55mol•L﹣1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
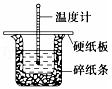
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
(3)实验中改用60mL 0.50mol•L﹣1盐酸跟50 mL 0.55mol•L﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”、“偏小”或“无影响”)
工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如下图:
(1)原料A的名称是,步骤①反应的离子方程式是。
(2) 滤液1中要加入稍过量原料B,原料B的化学式是,步骤②反应的离子方程式是:。
(3) 步骤③的化学方程式是:。
(4) 如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响。
设计一个实验证明明矾晶体KAl(SO4)2·12H2O中含有K+、Al3+、 和H2O。
和H2O。
(1)现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后,溶液颜色变浅,产生上述现象的原因是
(请用相关的反应方程式和简要文字说明)。
(2)在氯水中存在多种分子和离子,也可以通过实验的方法加以确定。下列说法错误的是
| A.加入含有NaOH的酚酞试液,红色褪去,说明有H+离子存在 |
| B.加入有色布条后,有色布条褪色,说明有HClO分子存在 |
| C.氯水呈浅黄绿色,且有刺激性气味,说明有C12分子存在 |
| D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl—离子存在 |
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有
①单质②氧化物③电解质④盐⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 |
|
| ②酸碱中和反应均可表示为:H++OH-=H2O |
有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—离子中的几种。为确定其成分,进行如下实验:①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰。下列推断正确的是
| A.肯定有Na+、Al3+、Mg2+、SO42— | B.肯定有Na+、Mg2+、Al3+、Cl— |
| C.肯定没有K+、HCO3—、MnO4— | D.肯定没有K+、NH4+、Cl— |