.现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为______ __
(2)该气体所含原子总数为 个。
利用“化学计量在实验中的应用”的相关知识进行填空
(3)含有6.02×1023个氧原子的H2SO4的物质的量是_______
(4)与标准状况下VLCO2所含氧原子数目相同的水的质量是_____ __
(5)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是__________ _____
(6)三种正盐的混合溶液中含有0.2 mol Na+、0 .25 mol M
.25 mol M g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___ ________
g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___ ________
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为。
SO2按还原性由强到弱顺序排列为。
II (4) 除去铁粉中混有铝粉的试剂是,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物: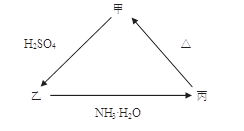
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙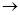 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙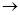 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲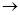 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
今有A.醋酸,B.盐酸, C.硫酸三种酸,请用三种酸的序号和“>”、“<”或“=”填空。
(1)在同体积,同pH的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是。
(2)在同体积、同物质的量浓度的三种酸中,分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积由大到小的顺序是。
(3)物质的量浓度均为0.1mol/L的三种酸溶液的pH由大到小的顺序是;如果取等体积的0.1mol/L的三种酸溶液,用0.1mol/L的NaOH中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是。
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
| A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) | B.c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D.c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
① 若为NH4Cl 溶液,则四种离子浓度的由大到小的顺序是___________。(填序号)
② 若为HCl 和NH4Cl 混合溶液,则四种离子浓度的由大到小的顺序是_________;
若为NH3· H2O 和NH4Cl 混合溶液,四种离子浓度的由大到小的顺序是__________。
③ 若该溶液是由体积相等的HCl溶液和氨水混合而成,且恰好呈中性,则混合前c(HCl) _____c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(OH-)____c(NH4+)。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。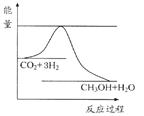
(1)关于该反应的下列说法中,正确的是。(填字母)
A.△H>0,△S>0B.△H>0,△S<0
C.△H<0,△S<0D.△H<0,△S>0
(2)该反应平衡常数K的表达式为。
(3)温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为mol·L-1·min-1。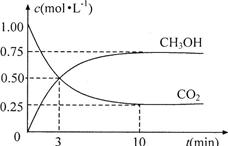
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2
E.充入He(g),使体系总压强增大