T ℃时在2 L 密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z 的浓度变化如图1 所示;若保持其他条件不变,温度分别为T1 和T2时,Y 的体积百分含量与时间的关系如图 2 所示。则下列结论不正确的是
| A.反应进行的前3 min 内,用X 表示的反应速率υ(X)=0.1 mol·L-1·min-1 |
B.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K 增大 |
| D.若在相同条件下充入4.0molX,3.2molY,0.8molZ,达到平衡后X 的转化率为30% |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
向Na2O2的水溶液中滴入酚酞变红色 |
Na2O2与水反应生成氢氧化钠 |
| B |
明矾能水解生成Al(OH)3胶体 |
实验室用明矾与水反应制Al(OH)3 |
| C |
SiO2是酸性氧化物 |
SiO2与任何酸均不反应 |
| D |
Zn具有还原性和导电性 |
可用作锌锰干电池的负极材料 |
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
Na2O2使酚酞溶液变红 |
Na2O2能漂白织物、纸浆 |
| B |
SO2可使石蕊溶液先变红后褪色 |
SO2的水溶液具有酸性和漂白性 |
| C |
NH3、HCl可用作喷泉实验 |
NH3、HCl都极易溶于水 |
| D |
晶体硅是良好的半导体材料 |
晶体硅可制作太阳能电池和光导纤维 |
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数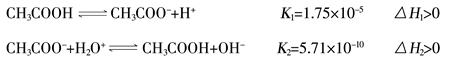
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
| A.混合溶液PH<7 |
| B.对混合溶液进行微热,K1增大、K2减小 |
| C.调节混合溶液的PH值至中性,则此时溶液中c(Na+)=c(CH3COO—) |
| D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO—)减小 |
下列实验中,依据实验操作及现象,得出的结论正确的是
| 操 作 |
现 象 |
结 论 |
|
| A |
测定等浓度的Na2CO3和Na2SO4 溶液的pH |
前者pH比后者的大 |
非金属性: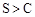 |
| B |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| C |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有 或 或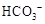 |
| D |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
M |
N |
R |
Q |
|
| 原子半径(×10-10 m) |
1.86 |
0.99 |
1.43 |
1.60 |
1.02 |
0.75 |
0.74 |
|
| 主要化合价 |
最高正价 |
+1 |
+7 |
+3 |
+2 |
+6 |
+5 |
—— |
| 最低负价 |
—— |
-1 |
—— |
—— |
-2 |
-3 |
-2 |
下列说法正确的是
A.气态氢化物的稳定性:N > Y
B.元素X和Q形成的化合物中不可能含有共价键
C.M(OH)2的碱性比XOH的碱性强
D.X、Z、R的最高价氧化物对应的水化物之间可两两相互反应