25℃、101 kPa时,1 g甲醇(CH3OH)完全燃烧生成CO2和液态H2O,同时放出22.68 kJ热量。下列表示该反应的热化学方程式中正确的是
A.CH3OH(l)+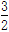 O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol |
| C.2CH3OH+3O2===2CO2+4H2O(l) ΔH=-22.68 kJ/mol |
D.CH3OH(l)+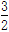 O2(g)===CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol O2(g)===CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol |
关于碱金属单质的性质叙述错误的是()
| A.在空气中燃烧都能生成过氧化物 | B.都能够与水反应 |
| C.都有较强的还原性 | D.最高价氧化物对应水化物都是强碱 |
元素的种类与原子的种类()
| A.前者大 | B.相同 | C.后者大 | D.无法确定 |
已知115号元素原子有七个电子层,且最外层有5个电子,试判断115号元素在元素周期表中的位置是()
| A.第七周期第IIIA族 | B.第七周期第VA族 |
| C.第七周期第IIIB族 | D.第七周期第VB族 |
113号元素原子(质量数是284)的中子数与质子数之差是()
| A.58 | B.0 | C.171 | D.60 |
放射性同位素钬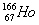 的原子核内的中子数与核外电子数之差是()
的原子核内的中子数与核外电子数之差是()
| A.99 | B.67 | C.32 | D.166 |