19.2g铜与一定量的浓硝酸反应,铜完全作用后收集到11.2L(标准状况)气体,则反应消耗的硝酸的物质的量可能为
| A.0.5 mol | B.0.8 mol | C.1.0 mol | D.1.1 mol |
设NA表示阿伏加德罗常数的数值,下列说法不正确的是
| A.标况下,22.4LN2和NH3混合气体中原子间共有3NA个共用电子对 |
| B.3.0g甲醛和乙酸混合物中共含碳原子数为0.1NA |
| C.在1L0.1mol/L的HCOOH溶液中,所含HCOO-与HCOOH粒子数之和为0.1NA |
| D.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
下列说法不正确的是
A.利用风能发电、采取节能技术、使用太阳能热水器均有利于降低大气中的二氧化碳
B.高容量储氢材料的研制是推广应用氢氧燃料电池的关键问题之一
C.生活垃圾焚烧发电也会产生有毒有害物质
D.蛋白质、麦芽糖、PVC、淀粉都属于高分子化合物
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
| A.原子半径:Na>Al |
| B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) |
| C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
| D.m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
已知反应:3BrF3+5H2O=Br2+HBrO3+9HF+O2,若生成标准状况下6.72L O2,则被H2O还原的BrF3的物质的量为
| A.0.3mol | B.0.4mol | C.0.6mol | D.0.9mol |
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是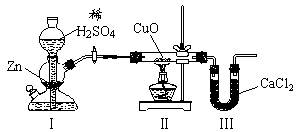
| A.Ⅰ、Ⅱ装置之间缺少干燥装置 | B.Ⅲ装置后缺少干燥装置 |
| C.CuO部分被还原成Cu2O | D.Ⅱ装置中玻璃管内有水冷凝 |