设NA代表阿伏伽德罗常数的值,下列说法正确的是
| A.2.3g钠与水反应失去的电子数目为0.2NA |
| B.20℃、101Kpa时,5.6L氨气所含的原子数目为NA |
| C.0℃、101Kpa时,18g铵根离子所含有的电子数为10NA |
| D.1mol氯化钠固体溶于1L水所得的溶液中氯化钠的物质的量浓度为1mol/L |
用0.10mol·L-1 NaOH溶液滴定0.10mol·L-1盐酸,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是( )
| A.4 | B.7.2 | C.10 | D.11.3 |
250C,向1 mL pH=a的盐酸 中滴加10 mL pH=b的NaOH溶液,当溶液中
中滴加10 mL pH=b的NaOH溶液,当溶液中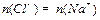 时,a+b的值为( )
时,a+b的值为( )
| A.13 | B.14 | C.15 | D.不能确定 |
在一密闭容器中充入1 mol CO和1 mol H2O(g),一定条件下反应: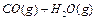
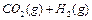 达到平衡时生成0.67mol CO
达到平衡时生成0.67mol CO 2,若在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为( )
2,若在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为( )
| A.1.34mol | B.1.0mol | C.0.94mol | D.0.52mol |
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡: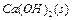
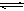
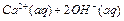 ,下列说法确的是( )
,下列说法确的是( )
| A.恒温下向溶液中加CaO,溶液的pH升高 |
| B.给溶液加热,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,其中固体质量增加 |
D.向溶液中加入少量NaOH固体,Ca(OH)2固体 质量不变 质量不变 |
弱电解质的电离程度可用电离度( )表示:
)表示: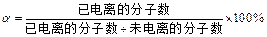 ,现有pH均为4的HCl和
,现有pH均为4的HCl和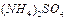 溶液,则两种溶液中H2O的电离度之比为( )
溶液,则两种溶液中H2O的电离度之比为( )
| A.1:2 | B.2:5 | C.1:106 | D.106:1 |